
【题目】铝土矿的主要成分是Al2O3、Fe2O3和SiO2等.从铝土矿中提炼Al2O3的流程如下: 
回答下列问题:
(1)写出反应1的化学方程式;
(2)滤液Ⅰ中加入CaO生成的沉淀是;
(3)工业生产中通入的气体A应过量,理由是;则反应2生成B的离子方程式为 .
【答案】
(1)Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O
(2)CaSiO3
(3)使铝元素完全转化为氢氧化铝沉淀;CO2+AlO2﹣+2H2O═Al(OH)3↓+HCO3﹣
【解析】解:铝土矿的主要成分是Fe2O3、Al2O3和SiO2等,从铝土矿中提炼Al2O3的工艺流程原理为:铝土矿加入NaOH溶液,二氧化硅与NaOH反应生成硅酸钠与水,氧化铝与NaOH反应生成偏铝酸钠与水,Fe2O3和NaOH溶液不反应,涉及的反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O;所以滤渣为在碱性条件下的不溶物Fe2O3 , 得到滤液1中含有AlO2﹣、SiO32﹣、OH﹣ , 加入CaO,CaOH和水反应生成Ca(OH)2 , Ca(OH)2与硅酸钠反应生成CaSiO3沉淀;滤Ⅱ中的溶质为NaAlO2 , 通入CO2 , B煅烧生成Al2O3 , 故B为Al(OH)3 , 气体A应该为CO2;
(1.)反应1的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O所以答案是:Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O;
(2.)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成CaSiO3沉淀,所以答案是:CaSiO3;
(3.)工业生产中通入的气体二氧化碳应过量,目的是使铝元素完全转化为氢氧化铝沉淀;则反应2生成B的离子方程式为CO2+AlO2﹣+2H2O═Al(OH)3↓+HCO3﹣ ,
所以答案是:使铝元素完全转化为氢氧化铝沉淀;CO2+AlO2﹣+2H2O═Al(OH)3↓+HCO3﹣ .


科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程. 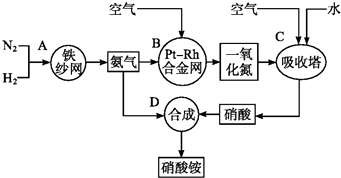
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是 , 写出B中有关反应方程式: .
(3)写出D中反应方程式: .
(4)A,B,C,D四个容器中的反应,属于氧化还原反应的是(填字母).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用高锰酸钾和浓盐酸来制取氯气,反应的化学方程式为
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
(1)浓盐酸在此反应中显示出来的性质是 .
(2)若有15.9g的高锰酸钾与足量的浓盐酸反应,则被氧化的氯化氢的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关。下列叙述错误的是
A.铝合金大量用于高铁建设B.考古时利用14C测定一些文物的年代
C.漂粉精可用作游泳池等场所的消毒剂D.氧化钠可在呼吸面具或潜水艇中作为氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中常见化学物质反应关系如下图。反应I、II、III、IV没有省略反应物和生成物;其他反应省略部分参与反应物质。D、O是常见金属,B常温下呈液态。C为淡黄色粉末,L为黑色固体且有磁性,Q为红褐色沉淀。E、F、H为常见气体。反应I条件为电解,是工业上重要的电解反应。

(1)P可以在溶液转变成Q,现象是_______________________
(2)C的电子式为___________________。
(3)D和L在一定条件下可以发生反应,该反应可放出大量的热。写出该反应的化学方程式________。
(4)a g C、D的混合物可以与b g B反应得到只含一种溶质的 c mL溶液,产生气体体积为V L,下列说法正确的是________________
A.V L气体中F和H的物质的量比为6:1
B.所得溶液密度为 ![]() g/mL
g/mL
C.向所得溶液中通入HCl气体,恰好使溶液中沉淀质量最大,则气体物质的量为![]() mol
mol
D.溶液的物质的量浓度为![]() mol/L
mol/L
(5)写出G溶液和K溶液混合反应的离子方程式________________________________。
(6)将一定量C加入M溶液中,若恰好将M溶液中阳离子氧化,写出该反应离子方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W是由A、B两种元素组成的AB2型化合物.
(1)若W是最常见的温室气体则其结构式为;
(2)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛.该反应的化学方程式为 .
(3)若W是离子化合物,其阴、阳离子均含18个电子,
①当阴、阳离子个数比为2:1时W的电子式为;
②当阴、阳离子个数比为1:1时阴离子的电子式为
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸.
①如A、B为相邻周期时B在元素周期表中的位置为 . W的水溶液被双氧水氧化的化学方程式为 .
②如果A元素的周期序数是B元素的两倍,A的最高价氧化物对应水化物的分子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是

A. 若A为H2O2,B为MnO2,C中盛有Na2S溶液, C中溶液变浑浊
B. 若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中盛有AlCl 3溶液, C中先产生白色沉淀后沉淀又溶解
D. 若A为浓H2SO4 ,B为CaCO3,C中盛有Na2SiO3 溶液,C中溶液出现白色沉淀,证明非金属性S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com