
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器
| 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
C
【解析】
试题分析:A、容器①、②的反应温度相同,所以平衡常数相同,正确;B、将②中的0.2mol的氨气转化为氮气、氢气,再与原来的氮气、氢气的物质的量相加,也是1mol氮气、3mol氢气,与①完全相同,所以二者达到的平衡是等效平衡,氨气的体积发生相同,①中放出的热量是23.15kJ,说明生成氨气的物质的量是23.15kJ/92.6kJ/mol×2=0.5mol,消耗氮气的物质的量是0.25mol,剩余氮气的物质的量是1-0.25=0.75mol,则剩余氢气的物质的量是0.75mol×3=2.25mol,所以氨气的体积分数也是物质的量分数为0.5/(0.75+2.25+0.5)=1/7,正确;C、因为二者是等效平衡,所以容器②中达平衡时氨气的物质的量也是0.5mol,所以氮气需消耗0.15mol,则放出的热量是0.15mol×92.6kJ/mol=13.89kJ,错误;D、若容器①体积为0.5L,容器体积增大,压强减小,平衡逆向移动,所以放出的热量小于23.15kJ,正确,答案选C。
考点:考查对等效平衡的判断及应用


科目:高中化学 来源:2015届浙江省慈溪市、余姚市高三上学期期中联考化学试卷(解析版) 题型:选择题
下列排列的顺序不正确的是
A.离子半径:O2->Na+ >Mg2+
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.热稳定性:HCl>PH3>H2S
D.结合氢离子能力:CO32->HCO3->SO42-
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中: 4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO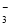 +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO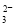 +2H2O
+2H2O
C.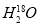 中投入Na2O2固体:2
中投入Na2O2固体:2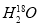 +2Na2O2===4OH-+4Na++18O2↑
+2Na2O2===4OH-+4Na++18O2↑
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO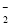 +4NH
+4NH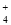 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
通过复习总结,下列归纳正确的是
A.酸酐一定是酸性氧化物
B.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
C.简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性
D.一种元素可能有多种氧化物,但同种化合价只对应有一种氧化物
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:填空题
(共12分)
电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
(1)某兴趣小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为_______________________。
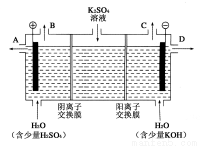
②得到的氢氧化钾从 (填A,或D)排放出。常温下,若将得到的2L浓度为0.25mol/L的KOH溶液与2L0.025mol/L的硫酸溶液混合(假设溶液混合后忽略体积变化),pH为
③此时通过阴离子交换膜的离子数 (填大于,小于或等于)通过阳离子交换膜的离子数。
④若将制得的氢气、氧气和硫酸溶液组合为氢氧燃料电池,则电池正极的电极反应式为____________________________________________
(2)如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。

①向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是______________________,D电极上的电极反应式为______________________。
②一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置的总的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
根据以下3个热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H =―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H =―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H =―Q3 kJ/mol
Q1、Q2、Q3三者关系正确的是
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q3>Q2>Q1 D.Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
室温下,0.1mol/L氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
①电离度增大 ②C(OH-)增大 ③C(H+)增大 ④KW增大 ⑤导电性增强 ⑥C(OH-)/C(NH3 ·H2O)增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
能源材料是当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见下图)可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是

A.C60、Si60、N60都属于新型化合物
B.C60、Si60、N60互为同分异构体
C.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
D.已知金刚石中C-C键长154pm,C60中C-C键长145 ~140pm,故C60熔点高于金刚石
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:填空题
(14分) 一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为(产物中只有一种酸根) 。请从反应原理分析不用盐酸酸化的主要原因____________________________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:__________________________________;____________________________。
(4)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液P。下列有关溶液P中微粒的物质的量浓度关系正确的是______(填序号)。
A.c(CO32-) > c(HCO3-)> c(OH-)> c(H+)
B.c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将P溶液与少量NaOH溶液混合:c(Na+)+ c(H+)= c(HCO3-)+ 2c(CO32-)+ c(OH-)
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com