
 CH3OH(g) ⊿H
CH3OH(g) ⊿H| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
 CH3OH(g)
CH3OH(g)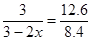
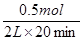 =0.0125 mol·L-1·min-1。该温度下平衡常数K=
=0.0125 mol·L-1·min-1。该温度下平衡常数K=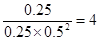 ;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。

科目:高中化学 来源:不详 题型:单选题
| A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
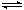 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小 |
| B.图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系 |
| C.图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响。可知反应物N2的转化率最高的是b点;T1>T2,K2> K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数) |
| D.图4表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图l为某金属单质晶体中原子的堆积方式,则其晶胞构型为体心立方 |
| B.图2为钢闸门的防腐原理示意图,则钢闸门应与电源的正极相连 |
| C.图3表示CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| D.图4表示在容积相同的恒容密闭容器中,等量的N02在不同温度下反应: |
 N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O
N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水晶是无色透明的晶体,可用制作硅太阳能电池 |
| B.配制0.1 mol/LNaCl溶液,若定容时俯视,则所得溶液浓度偏小(其它操作均正确) |
| C.向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积不变 |
| D.已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H="+74.9" kJ·mol-1,因此该反应一定不能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

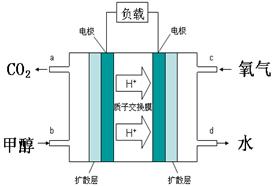
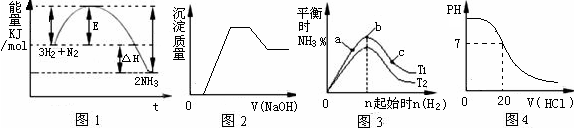
 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ΔH<0,(Ⅱ)3A(g)
2C(g) ΔH<0,(Ⅱ)3A(g)  D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是
D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是| A.仅① | B.①③ | C.①②③ | D.都不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com