
| A. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| C. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
分析 A.二氧化碳过量,反应生成碳酸氢根离子;
B.铁离子在沸水中水解生成氢氧化铁胶体;
C.氢氧化钡过量,离子方程式按照硫酸氢钠的化学式书写;
D.0.1mol/L、pH=1的NaHA溶液,说明NaHA完全电离,离子方程式中HA-应该拆开.
解答 解:A.硅酸钠溶液中通入过量的CO2,反应生成硅酸和碳酸氢根离子,正确的离子方程式为:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故A错误;
B.将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体,反应的离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故B正确;
C.向NaHSO4溶液中加入过量的Ba(OH)2溶液,正确得到离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故C错误;
D.0.1mol/LNaHA溶液的pH=1,说明NaHA完全电离,离子方程式中HA-需要拆开,正确的离子方程式为:H++OH-═H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 目的 | 实验室制O2 | 配置稀硫酸溶液 | 在铁制品上镀铜 | 检查装置气密性 |
| 装置或操作 | 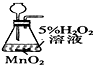 | 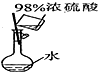 | 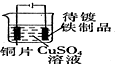 | 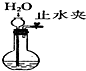 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3 | B. | Fe(OH)2 | C. | FeCl2 | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
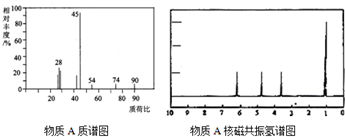
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 182.7 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | MgCl2所含离子键的强度比NaCl大 | ||
| C. | AlCl3加热能升华 | D. | 单质B是原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
②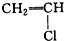 ③
③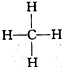 ④
④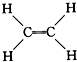 ⑤CH3CH2OH,⑥C6H12O6,⑦CH3COOH,⑧硬脂酸甘油酯,⑨聚乙烯
⑤CH3CH2OH,⑥C6H12O6,⑦CH3COOH,⑧硬脂酸甘油酯,⑨聚乙烯| A. | 能与溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑨ | |
| B. | 投入钠能产生H2的是⑤⑦⑧ | |
| C. | 属于高分子材料的是⑧⑨ | |
| D. | 既能和NaOH溶液反应又能与NaHCO3溶液反应的是 ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | X元素的最外层电子数为2 | B. | Y的气态氢化物的化学式为HY | ||
| C. | Z的最高价氧化物的化学式为ZO2 | D. | X、Y、Z的单质中X单质最稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com