
| A. | 化学反应中能量变化的大小与反应物的多少无关 | |
| B. | 化学反应必然伴随能量的变化 | |
| C. | 化学反应中能量的主要是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |
分析 A、反应中的能量变化的大小与反应物的物质的量成正比;
B、化学反应一定伴随着能量变化;
C、断开化学键需要吸收能量,形成化学键要放出能量;
D、化学反应的特征有:一定有新物质生成,一定有化学键额断裂和形成,一定有能量变化等.
解答 解:A、反应中的能量变化的大小与反应物的物质的量成正比,参与反应的反应物的量越多,则反应中的能量变化越大,故A错误;
B、化学反应一定伴随着能量变化,不存在既不吸热也不放热的反应,故B正确;
C、断开化学键需要吸收能量,形成化学键要放出能量,所以化学反应要伴随着能量的变化,即化学反应中能量的主要是由化学键变化引起,故C正确;
D、化学反应的特征有:一定有新物质生成,一定有化学键额断裂和形成,一定有能量变化,故能量变化是化学反应的基本特征之一,故D正确.
故选A.
点评 本题考查了化学反应与能量变化之间的关系,应注意化学反应一定有能量变化,但有能量变化的不一定是化学反应.


科目:高中化学 来源: 题型:选择题
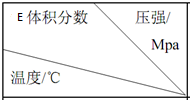 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 915℃,2.0 MPa 时 E 的转化率为 60% | |
| B. | K(810℃)>K(1000℃) | |
| C. | 该反应可在较低温度下自发进行 | |
| D. | e>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
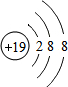 、
、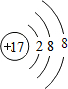 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 合金的熔点比它的各成分金属的熔点低 | |
| B. | 合金一定是金属熔合而成的物质 | |
| C. | 合金的硬度和强度一般比纯金属大 | |
| D. | 硬铝、黄铜、钢等均为合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
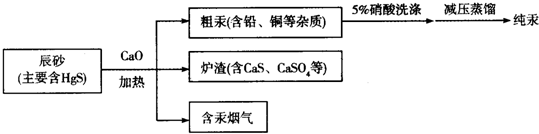
| A. | 流程中加入氧化钙的目的是减少SO2的排放 | |
| B. | “辰砂”加热时发生反应:HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2,该方法属于热分解法 | |
| C. | 洗涤粗汞时可用5%的盐酸代替5%的硝酸 | |
| D. | 含汞烟气中汞的含量很低,可以直接排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com