
通常情况下,Fe2+及亚铁化合物在空气中易被氧气氧化为Fe3+或铁的化合物。尤其是在碱性条件下,氧化反应进行得十分迅速。用下列两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的溶液与用不含氧气的蒸馏水配制的NaOH溶液反应制备。
(1)用FeSO4晶体配制上述FeSO4溶液时,为防止溶液中Fe2+被氧化,需加入________。
(2)除去蒸馏水中溶解的氧气常采用__________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含氧气的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是___________________________。
方法二:在如图所示装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。
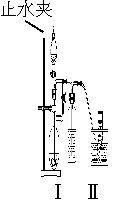
(1)在试管Ⅰ里加入的试剂是____________。
(2)在试管Ⅱ里加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________。
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
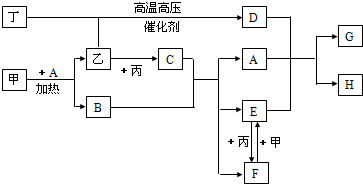
科目:高中化学 来源: 题型:阅读理解
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
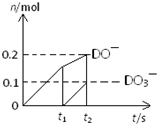
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
查看答案和解析>>
科目:高中化学 来源: 题型:
用不含Fe3+的FeSO4溶液与不含氧气的蒸馏水配制的NaOH溶液反应制备。
(1)为防止所得溶液里的Fe2+被氧化,用硫酸亚铁晶体来配制上述FeSO4溶液时,还需加入________________________________________________。
(2)除去蒸馏水中溶解的氧气常采用什么方法?
(3)生成氢氧化亚铁沉淀的操作是:用长滴管吸取不含氧气的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com