
分析 I.依据氯气与水反应生成产物的性质判断解答:
Ⅱ.(1)氯气和氢氧化钠反应生成NaCl、NaClO、水;
(2)依据方程式Cl2+2NaOH=NaCl+NaClO+H2O及物质的量计算解答;
(3)①依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
②依据配制一定物质的量浓度溶液一般步骤排序;
③依据m=CVM计算需要溶质的质量;
④分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:I.氯气溶液水生成盐酸和次氯酸,使溶液呈酸性,紫色石蕊溶液遇到酸显红色,生成的次氯酸具有漂白性,能够使变红的石蕊褪色,所以看到现象为:溶液变为红色,然后褪色;
故答案为:溶液变为红色,然后褪色;氯气溶液水生成盐酸和次氯酸,使溶液呈酸性,紫色石蕊溶液遇到酸显红色,生成的次氯酸具有漂白性,能够使变红的石蕊褪色;
Ⅱ.(1)氯气和氢氧化钠反应生成NaCl、NaClO、水,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol
由Cl2+2NaOH=NaCl+NaClO+H2O
知n(NaOH)=2n(Cl2)=2×0.1mol=0.2mol
V(NaOH溶液)=$\frac{0.2L}{4.0mol/L}$=0.05L,
故答案为:0.05;
(3)①配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等用到的仪器:烧杯、玻璃棒、100mL容量瓶、胶头滴管,用不到的仪器:锥形瓶;
故答案为:D;
②配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,正确的操作步骤为:abdcfe;
故答案为:abdcfe;
③配制100mL4.0mol•L-1NaOH溶液,需要氢氧化钠的质量m=0.1L×4.0mol/L×40g/mol=16.0g;
故答案为:16.0;
④A.没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.如果加水超过了刻度线,取出水使液面恰好到刻度线,导致溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.容量瓶没有干燥,对溶质的物质的量和溶液体积的不产生影响,溶液浓度不准确,故C选;
故选:C.
点评 本题考查了元素化合物性质及一定物质的量浓度溶液的配制,明确氯气的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:3 | B. | 2:3 | C. | 10:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用品红溶液鉴别CO2和SO2 | |
| B. | 用湿润的pH试纸测稀碱液的pH | |
| C. | 用NaOH溶液液鉴别MgCl2和AlCl3溶液 | |
| D. | 用焰色反应鉴别NaCl和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
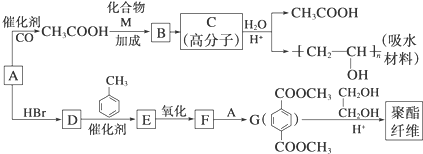
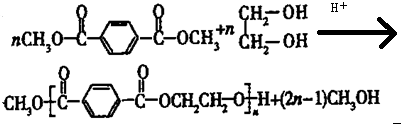 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 沸点不同的液体可用蒸馏的方法分离 | |
| B. | 易溶与难溶的固体混合物可用溶解、过滤、蒸发、结晶的方法分离 | |
| C. | 用酒精可以从碘水中萃取碘 | |
| D. | 汽油和水的化合物不可以用分液漏斗分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com