
| A. | OH- | B. | NO3- | C. | CO32- | D. | Ag + |
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
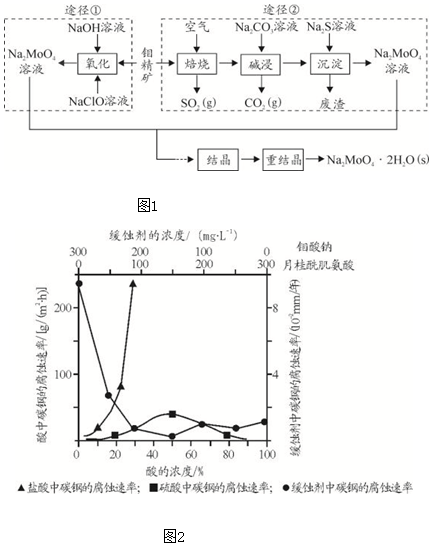

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
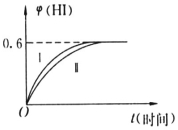 将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
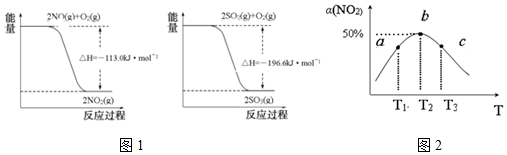
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com