
| 编号 | 反应条件 | 反应速率 |
| (1) | 升高温度 | |
| (2) | 加入催化剂 | |
| (3) | 再充入amolH2 | |
| (4) | 将容器容积扩大为原来2倍 |
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
 qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图所示,有关叙述正确的是( )。
qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图所示,有关叙述正确的是( )。| A.n<q |
| B.n>q |
| C.X点,v正>v逆;Y点,v正<v逆 |
| D.X点比Y点反应速率快 |
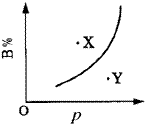 |
| |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g):ΔH<0。降低温度时,对反应产生的影响是( )
2Z(g):ΔH<0。降低温度时,对反应产生的影响是( )| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向正反应方向移动 |
| D.正、逆反应速率都增大,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg,0.1 | 5mol/L盐酸10mL | 60 |
| B | Mg,0.1 | 3mol/L盐酸10mL | 60 |
| C | Fe,0.1 | 3mol/L盐酸10mL | 60 |
| D | Mg,0.1 | 3mol/L盐酸10mL | 50 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用催化剂一定能加快反应速率 |
| B.用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率 |
| C.当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 |
| D.在合成氨反应中,增大N2浓度一定可以使H2的转化率达到100% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 反应时间t(h) | 1 | 4 | 9 | 16 | 25 |
| MgO膜厚Y(nm) | 0.02a | 0.08a | 0.18a | 0.32a | 0.50a |
| ZnO膜厚Y(nm) | 1.0×10-3b | 4.0×10-3b | 9.0×10-3b | 1.6×10-2b | 2.5×10-2b |
| NiO膜厚Y(nm) | 0.3c | 0.6c | 0.9c | 1.2c | 1.5c |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com