
| A. | 全部由非金属元素构成的化合物中肯定不存在离子键 | |
| B. | 所有物质中都存在化学键 | |
| C. | 已知乙炔的结构式为CH≡CH,则乙炔中σ键和π键之比为3:2 | |
| D. | 乙炔分子中只存在σ键,不存在π键 |
分析 A.铵盐部由非金属元素构成,为离子化合物;
B.单原子分子不含有化学键;
C.叁键中有两个π键和一个σ键;
D.C≡C含有两个π键.
解答 解:A.铵盐部由非金属元素构成,为离子化合物,如氯化铵等,存在离子键,故A错误;
B.单原子分子不含有化学键,如He等,故B错误;
C.叁键中有两个π键和一个σ键,乙炔中存在3个σ键(C-H、C-C)和2个π键(C≡C),σ键和π键之比为3:2,故C正确;
D.乙炔含有C≡C,含有两个π键,故D错误.
故选C.
点评 本题考查化学键与化合物的分类,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重常见物质中化学键的考查,注意利用实例分析,题目难度不大.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:选择题
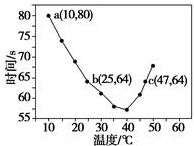
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3、NH4NO3 | B. | (NH4)2CO3、NH4NO3 | C. | NH4HCO3、NH4Cl | D. | NH4Cl、(NH4)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

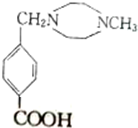 .
.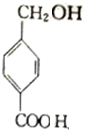 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$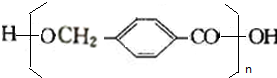 +(n-1)H2O
+(n-1)H2O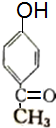 +2Br2→
+2Br2→ +2HBr.
+2HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
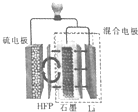 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减少,阴极质量增加 | |
| C. | 放电时,正极的电极反应式为S62-+10e-=6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com