
| A. | 碳铵分解是放热反应,根据能量判据不能自发进行 | |
| B. | 碳铵分解是因为外界给予能量 | |
| C. | 碳酸盐都不稳定,都能自发分解 | |
| D. | 碳铵分解是因为生成了易挥发的气体,使体系的熵值增大 |
分析 碳酸铵室温下自发地分解生成氨气,发生反应的化学方程式为(NH4)2CO3=NH3↑+CO2↑+H2O,反应生成了气体氨气和二氧化碳,所以熵变增大;反应自发进行的判断依据是△H-T△S<0,自发进行,△H-T△S>0反应不能自发进行,△H-T△S=0反应达到平衡.
解答 解:A、碳铵分解是吸热反应,不是放热反应,故A错误;
B、碳酸铵在室温下就能自发地分解,外界没有提供能量,故B错误;
C、有的碳酸盐稳定,不能自发分解,如Na2CO3受热不分解,故C错误;
D、碳铵自发分解,是因为体系由于氨气和二氧化碳气体的生成而使熵增大,故D正确;
故选D.
点评 本题考查了反应自发进行的判断依据是由焓变和熵变共同决定的,注意把握焓变和熵变含义的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol 0.50mol 0.12mol | B. | 0.66mol 0.50mol 0.24mol | ||
| C. | 0.64mol 0.50mol 0.24mol | D. | 0.64mol 0.02mol 0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
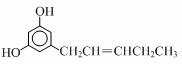
| A. | 既有σ键又有π键 | |
| B. | O-H键的极性比强于C-H键的极性 | |
| C. | 是非极性分子 | |
| D. | 该物质的分子之间不能形成氢键,但它可以与水分子形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 50 mL 1 mol•L-1 NaCl溶液 | B. | 100 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 1 mol•L-1 CuCl2溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子通式为CnH2n+2的烃不一定是烷烃 | |
| B. | 烯烃在适宜的条件下只能发生加成反应,不能发生取代反应 | |
| C. | 在烷烃分子中,所有的化学键都是单键 | |
| D. | 分子式是C4H8的烃分子中一定含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石是自然界最坚硬的单质 | |
| B. | 1 mol CO2中含有的共用电子对数目为2NA | |
| C. | 46g Na完全反应需要标准状况下CO2的体积为33.6L | |
| D. | 当有0.4mo1 Na参与反应时,被还原的CO2的分子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com