

| 物质 | Fe(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 4.0×10-38 | 2.0×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
分析 高铁菱锰矿(主要含MnCO3、FeCO3以及钴、镍等碳酸盐杂质、SiO2等),用硫酸酸浸,碳酸盐与硫酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有硫酸锰、硫酸亚铁、硫酸镍、硫酸钴及剩余的硫酸,向滤液中加入二氧化锰,可以将亚铁离子氧化为铁离子,加入氨水调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,所以滤渣Ⅱ为Fe(OH)3,过滤除去,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的硫酸锰溶液电解,可以得到金属锰和硫酸,硫可以再循环利用,对高铁菱锰矿进行酸溶,据此答题.
解答 解:高铁菱锰矿(主要含MnCO3、FeCO3以及钴、镍等碳酸盐杂质、SiO2等),用硫酸酸浸,碳酸盐与硫酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有硫酸锰、硫酸亚铁、硫酸镍、硫酸钴及剩余的硫酸,向滤液中加入二氧化锰,可以将亚铁离子氧化为铁离子,加入氨水调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,所以滤渣Ⅱ为Fe(OH)3,过滤除去,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的硫酸锰溶液电解,可以得到金属锰和硫酸,硫可以再循环利用,对高铁菱锰矿进行酸溶,
(1)根据上面的分析可知,MnCO3溶浸时反应的化学方程式为MnCO3+H2SO4=MnSO4+CO2↑+H2O,滤渣Ⅰ的主要成分为 SiO2,
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O; SiO2;
(2)氧化时二氧化锰被亚铁离子还原成锰离子,亚铁离子被氧化成铁离子,反应的离子方程式 为MnO2+4H+2Fe2+=Mn2++2Fe3++2H2O,
故答案为:MnO2+4H+2Fe2+=Mn2++2Fe3++2H2O;
(3)加氨水调节溶液的pH至5.0~6.0,滤渣Ⅱ的主要成分为Fe(OH)3,若溶液的pH偏高,锰离子会形成氢氧化锰沉淀,会导致溶液中锰元素的含量降低,
故答案为:Fe(OH)3;溶液中锰元素的含量降低;
(4)由于CoS的Ksp大于NiS的Ksp,所以溶液中硫离子的浓度最大值按镍离子计算,所以c(S2-)最大=$\frac{K{\;}_{sp(NiS)}}{c{\;}_{(N{i}^{2+})}}$=$\frac{1.0×10{\;}^{-22}}{1.0×10{\;}^{-5}}$ mol•L-1=10-17mol•L-1,
故答案为:10-17;
(5)电解硫酸锰溶液时,阴极上是锰离子得电子生成锰单质,电极反应式为Mn2++2e-=Mn,
故答案为:Mn2++2e-=Mn.
点评 本题物质制备实验,明确原理是解题关键,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和稀盐酸反应CO32-+2 H+═CO2↑+H2O | |
| B. | 铜和稀硝酸反应3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O | |
| D. | 铝和烧碱溶液反应 A1+2OH-═A1O2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
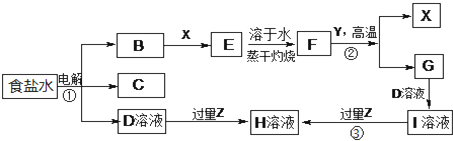
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| B. | MgCO3与NaOH溶液反应生成沉淀:MgCO3+2OH-═Mg(OH)2↓+CO32- | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 向NH4HSO4溶液中滴加过量NaOH溶液:NH4++HSO4-+2OH-═SO42-+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Fe3+完全水解,生成氢氧化铁胶体的数目为NA | |
| B. | 22.4 LCl2 分别与足量的Cu、Fe完全反应转移电子数分别为2 NA、3NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA | |
| D. | 1 mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
(1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下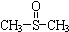 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中共价键越强,熔沸点越高 | |
| B. | 只含共价键的物质,一定是共价化合物 | |
| C. | HF的分子间作用力大于HCl,故HF比HCl更稳定 | |
| D. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com