
汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂
法”制取汞。目前工业上制粗汞的一种流程图如下。

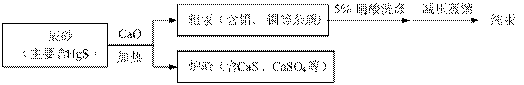
下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为:
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.洗涤粗汞可用5%的盐酸代替5%的硝酸
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(一)将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程为___________________________________________________________,
若将钠块放到石棉网上加热会生成淡黄色固体,该反应的化学方程式为:___________________________________________________________________,
该固体遇水会有无色无味的气体生成,该反应的化学方程式为:
___________________________________________________________________;
通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为 ;
工业上用氯气和石灰乳反应制漂白粉,漂白粉的有效成分是 ,
漂白粉长时期露至在空气中会失效,用化学方程式表示其失效的原因:
, 。
(二)某兴趣小组为探究Na2O2滴入酚酞试液中时溶液颜色变化的原因,设计如下方案。将2药匙Na2O2加入滴有3~4滴酚酞试剂的蒸馏水(10ml)中,发现有如下现象:
①立即有大量气泡生成。
②无色透明的酚酞溶液迅速变红,振荡后,溶液中的红色褪去,又变为无色。
③反应放出大量的热量,试管壁手触感觉很烫。
请回答:
(1)该兴趣小组同学认为酚酞试液颜色变化的为:
假设①: 。
假设②:可能是反应放出的热量,使红色消失。
假设③:可能是Na2O2与水反应生成的NaOH溶液浓度太大,使得酚酞变性,不显颜色。
(2)验证假设②,设计补充实验:取滴加酚酞的稀NaOH溶液加热,若红色消失,则证明假设②成立;若红色不消失,则假设②不成立。
(3)验证假设③,设计补充实验: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
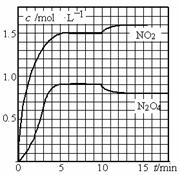 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃, 10min后升高并维持容器的温度为T2℃。下列说法正确的是( )
A.前5min反应的平均速率v(N2O4)=0.18mol·L-1·s-1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2. 0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组,收集了一种合金进行研究(已知Cu的焰色反应为绿色)。
(1)外观暗灰色,表面光滑;
(2)在酒精灯上灼烧,火焰呈绿色;合金片熔化,但不滴落;
(3)取刮去表皮的金属10.0 g,放入足量稀硫酸溶液中,收集到标准状况下的H29.96 L;
(4)另取刮去表皮的金属10.0 g,放入足量NaOH溶液中,也收集到标准状况下的H29.96 L。
试据此判断,合金中一定含有的元素是 (写元素符号);下列元素可能含有的是 (填选项编号)。
a.Ag b.Mg c.Mn d.Fe
如果该合金中,只含两种元素,它们的质量比是______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在AlCl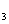 和FeCl
和FeCl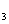 混合溶液中,先加入过量的KI溶液,再加入足量的Na
混合溶液中,先加入过量的KI溶液,再加入足量的Na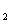 S溶液,所得 到的沉淀物是
S溶液,所得 到的沉淀物是
A.Fe(OH)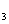 、Al(OH)
、Al(OH)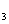 B.Al(OH)
B.Al(OH)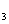 、I
、I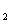
C.Fe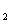 S
S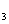 、I
、I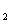 D.FeS、S、Al(OH)
D.FeS、S、Al(OH)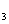
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g)ΔH = -197 kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH = -197 kJ/mol。实验测得起始、平衡时的有关数
据如下表。下列正确的是
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
A.Q1 =Q3<Q2
B.达到平衡时,乙容器中SO2的体积分数最大
C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小
D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHCO3和Na2O2按1∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
A.Na2O2和NaHCO3 B.NaHCO3和Na2CO3
C.NaOH和Na2CO3 D.只有Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式如图: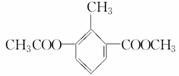 ,关于该物质的叙述错误的是
,关于该物质的叙述错误的是
( )。
A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.含有一种含氧官能团
D.该物质与乙酸乙酯为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com