
下列说法中,不正确的是:
A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种
B.第三周期元素的离子半径大小比较:Cl->S2->Na+>Mg2+>Al3+
C.日本福岛核电站释放出的放射性核素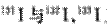 互为同位素
互为同位素
D.相同条件下,测定同浓度的H2CO3溶液和H2SO4溶液的酸性,可比较C和S的非金属性强弱
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )
A.溶液中c(Na+)=2c(SO )
)
B.0<沉淀的物质的量<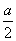 mol
mol
C.沉淀的物质的量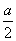 mol
mol
D.原溶液中c(H2SO4)=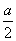 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液( )
(2014·广东理综,9D)
(2)溶解度小的沉淀易向溶解度更小的沉淀转化,所以ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀( )
(2014·安徽理综,12D)
(3)验证Fe(OH)3的溶解度小于Mg(OH)2,可将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色( )
(2014·四川理综,4D)
(4)25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度( )
(2014·重庆理综,3D)
(5)AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)( )
(2013·重庆理综,2D)
(6)CaCO3难溶于稀硫酸,也难溶于醋酸( )
(2013·天津理综,5B)
查看答案和解析>>
科目:高中化学 来源: 题型:
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2____Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是______________。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
①Ⅰ中,反应的化学方程式是_________________________________________。
②Ⅱ中,能与盐酸反应溶解的物质有_________________________________。
③Ⅳ的目的是_________________________________________________________。
④下列关于该工艺流程的说法正确的是________(填字母)。
a.该工艺产生的废液含较多的NH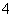 、Na+、Cl-、SO
、Na+、Cl-、SO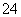
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是:
①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H= -114.6kJ·mol-1 则中和热为57.3kJ·mol-1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
A.②④⑥ B.①⑤⑥ C.②③④ D.①⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
(一)实验方法测定反应热---------中和热测定
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ |
(2)他们记录的实验数据如下:
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表。△H=
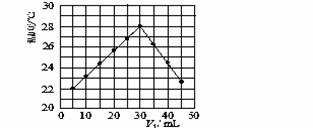
(3)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,此反应所用NaOH溶液的浓度应为 mol/L。
(二)通过化学计算间接获得
(1)已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H= kJ·mol-1
(2)已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为 kJ·mol-1;
查看答案和解析>>
科目:高中化学 来源: 题型:
将充有n mL NO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2。m>n,则充分反应后,试管中气体在同温同压下的体积为 ( )
A.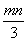 mL B.
mL B.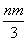 mL C.
mL C.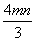 mL D.
mL D.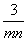 mL
mL
查看答案和解析>>
科目:高中化学 来源: 题型:
玫瑰的香味物质中包含苧烯,苧烯的键线式为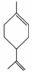 。
。
(1)1 mol苧烯最多可以跟________mol H2发生反应。
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构______________(用键线式表示)。
(3)有机物A是苧烯的同分异构体,分子中含有“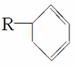 ”结构,A可能的结构为________________________________________________________________________
”结构,A可能的结构为________________________________________________________________________
___________________________________________________________(用键线式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com