
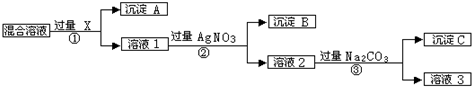
分析 由实验流程可知,如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3.
解答 解:(1)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,
故答案为:除去过量的Ba(NO3)2〔或BaCl2〕和AgNO3;
(2)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加热蒸发、冷却结晶、过滤得到硝酸钠,
故答案为:Na2CO3;HNO3;加热蒸发、冷却结晶、过滤;
(3)①检验所得的NaNO3固体中是否含有NaCl和Na2SO4,先检验硫酸根离子,选择试剂为Ba(NO3)2、HNO3,检验是否加入过量的方法是:静置分层,继续滴加Ba(NO3)2无沉淀生成,说明加入试剂过量,
故答案为:SO42-;Ba(NO3)2、HNO3,静置分层,继续滴加Ba(NO3)2无沉淀生成,说明加入的硝酸钡试剂过量;
②过滤后,向滤液中加硝酸银生成白色沉淀,再加硝酸沉淀不溶解,即可检验,
故答案为:过滤;AgNO3、HNO3.
点评 本题考查物质的分离提纯操作,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.


科目:高中化学 来源: 题型:选择题
| A. | HA是弱酸 | B. | HA的电离方程式为HA═H++A- | ||
| C. | 该溶液中c(HA)+c(A-)=0.1 mol•L-l | D. | NaA溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 两烧杯中参加反应的锌等量 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
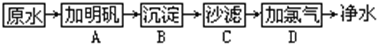
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
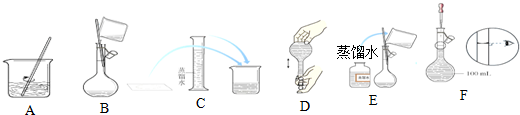
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度 | B. | 升高温度 | ||
| C. | 将固体反应物粉碎 | D. | 增大体系压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、AlO2-、SO42-、NO3- | |
| B. | b点对应的溶液中:Ba2+、K+、NO3-、Cl- | |
| C. | c点对应的溶液中:Na+、Ag+、Mg2+、NO3- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com