
| A、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B、因为氯气能和Fe反应,所以液氯不能装在干燥的钢瓶里 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合发生爆炸 |
| D、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
| ||
| ||


科目:高中化学 来源: 题型:
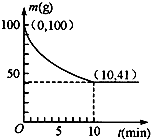 镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:| 350℃ |
| 470℃ |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、c(H+)=10-7mol/L的溶液 |
| C、氨水与氯化铵的混合液中c(NH4+)=c(Cl-) |
| D、c(H+)/c(OH-)=10-14的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、结晶时,若溶质的溶解度越大,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细大 |
| B、用移液管量取液体,吸取液体后,将移液管垂直放入容器中,管尖与容器内壁不得接触,松开食指使溶液全部流出 |
| C、在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4 |
| D、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定用的锥形瓶和滴定管都要用所盛溶液润洗 |
| B、配制一定物质的量浓度的溶液时,所用的容量瓶要预先干燥 |
| C、乙醇、乙酸、乙酸乙酯三种液体可用饱和Na2CO3溶液鉴别 |
D、如图装置可用于分离沸点不同的液体混合物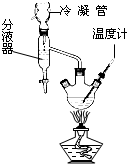 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中的负极质量一定减轻 |
| B、电解精炼铜时精铜做阳极 |
| C、金属被腐蚀的实质是金属原子失电子被氧化 |
| D、钢铁发生吸氧腐蚀时的负极反应为:Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol?L-1 Na2CO3溶液中:c (OH-)=c (HCO3-)+c (H+)+c (H2CO3) |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl-) |
| C、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3?H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| D、含有NH4+、Cl-、OH-、H+的溶液中,离子浓度一定是c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com