
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有1mL浓硫酸的试管中加入5mL 0.1mol•L-1 的 K2Cr2O7溶液 | 溶液橙色变深 | 増大生成物浓度,平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+逆向移 动 |
| B | 向Mg(OH)2悬浊液中加入少量 氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+?Mg2++2NH3•H2O具有可逆性 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡 在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火 焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫酸电离出氢离子,抑制平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,平衡逆向移动;
B.氯化铵可结合氢氧化镁电离出的氢氧根离子;
B.构成原电池时Zn为负极,Fe为正极;
D.C燃烧生成二氧化碳,能量变化与途径无关.
解答 解:A.硫酸电离出氢离子,抑制平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,平衡逆向移动,则溶液橙色变深,故A正确;
B.氯化铵可结合氢氧化镁电离出的氢氧根离子,发生Mg(OH)2+2NH4+?Mg2++2NH3•H2O,不能说明反应具有可逆性,故B错误;
B.构成原电池时Zn为负极,Fe为正极,结论不合理,故C错误;
D.C燃烧生成二氧化碳,能量变化与途径无关,则煤炭燃烧放出热量不变,结论不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握平衡移动、原电池、反应中能量变化为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 使酚酞变红色的溶液中:Na+、Na+、SO32-、NO3- | |
| C. | 能与金属铝反应生成氢气的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 无色透明的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
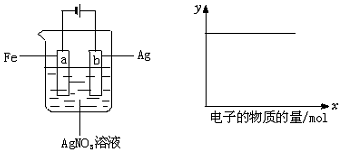
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(4) | D. | (1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
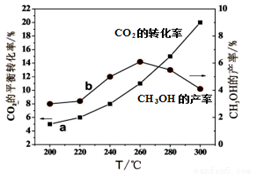 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
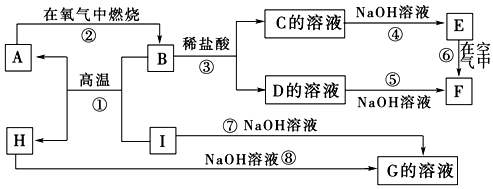
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:
实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com