
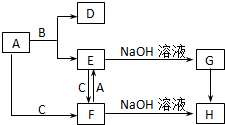
 如图所涉及的物质均为中学化学中的常见物质,其中C为黄绿色气体,A为金属单质,D在C中燃烧发出苍白色火焰,生成J,B是J的水溶液,
如图所涉及的物质均为中学化学中的常见物质,其中C为黄绿色气体,A为金属单质,D在C中燃烧发出苍白色火焰,生成J,B是J的水溶液,

 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| A、0.1mol?L-1的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| C、pH=11的Na2CO3溶液中:c(Na+)-2c(CO32-)-c(HCO3-)=10-3-10-11 |
| D、浓度分别为0.1mol?L-1和0.01mol?L-1的CH3COOH溶液中:c(CH3COO-)前者为后者的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
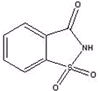 糖精是最古老的合成甜味剂,于1878年被美国科学家发现,其甜味是蔗糖的300~500倍,不被人体代谢吸收,在各种食品生产过程中都很稳定.缺点是风味差,有后苦,这使其应用受到一定限制.糖精的化学名称为邻苯甲酰磺酰亚胺,其结构简式如图所示,它的分子式为( )
糖精是最古老的合成甜味剂,于1878年被美国科学家发现,其甜味是蔗糖的300~500倍,不被人体代谢吸收,在各种食品生产过程中都很稳定.缺点是风味差,有后苦,这使其应用受到一定限制.糖精的化学名称为邻苯甲酰磺酰亚胺,其结构简式如图所示,它的分子式为( )| A、C7H8O3NS |
| B、C7H7O3NS |
| C、C7H6O3NS |
| D、C7H5O3NS |
查看答案和解析>>
科目:高中化学 来源: 题型:
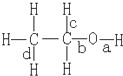 乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:
乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:查看答案和解析>>
科目:高中化学 来源: 题型:
 【物质结构与性质】
【物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
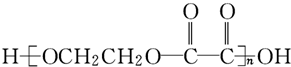 的过程是:
的过程是:| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
| ⑥ |
| ⑦ |
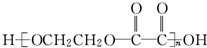
查看答案和解析>>
科目:高中化学 来源: 题型:
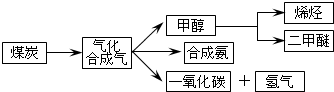
| c(H2)?c(CO) |
| c(H2O) |
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol/L) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小 |
| B、实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| C、常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |
| D、常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com