
���� ��1��A������̬�ĵ���������������Ϊ�����·�����Ӧ���ɻ���̬��
B����ҵ����������ʱ�����õ��dz�ѹ��
C����ⱥ��ʳ����������������
D��֧�����ѱ�ϸ�������ʹˮ����Ⱦ��
E���Ȼ������ǿ�������Σ�ˮ�������ԣ�
F��������������ǿ�Ļ�ԭ�ԣ����ױ�������
G������������ָ�����õ糡�����ã�ǿ�н�������缫����������ʹ�缫�м䲿λŨ�ȴ�Ϊ�½����Ӷ��Ƶõ�ˮ�ķ�����
H����ˮ��þ�ǽ���ˮ�е�þ����ת��Ϊ������þ�������룬Ȼ��ת��Ϊ�Ȼ�þ��������ڵ��Ȼ�þ�õ�þ���ʣ�
I������̼��ѧ�ĸ����жϽ��
J����ѧ���������������ʯ��Ĥ��ԭ��Ϊ��CH4$\stackrel{һ��������}{��}$C�����ʯ��+2H2��
K������ʹ�õ���ʯ�ң���ʯ�������ֵ�������֮һ��
L��������ڵ���������ȡ����
��2���۱�ϩ�����DZ�ϩ���ƼӾ۷�Ӧ�IJ������Ϊ��ϩ���ƣ�
��3�������������Ӧ���ɾ��и�ʴ�Ե�����������
��4����SiCl4��H2��O2��Ӧ�����������֣����ά����Ҫ�ɷ���SiO2��H��ClԪ�ر�����һ�����У�H��ClԪ�ؽ�ϳ�HCl��Ȼ����ƽ���ɣ�
����������ʽ������ƽ��ʱH2��SiHCl3���ʵ���Ũ�ȣ��������ʼ���ʵ������ٸ���2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2NaOH��������������Ĵ�NaCl��������
��5�����ݵ�ʧ�����غ㣬NaClת��ΪNaClO3��ʧȥ�ĵ��ӵ���H2Oת��ΪH2���õ��ĵ��ӣ��������Ƶ�������������Ƶ����ʵ������������NaClת��ΪNaClO3��ʧȥ�ĵ��ӵ����ʵ��������������������ڱ�״���µ������
��� �⣺��1��A������̬�ĵ���������������Ϊ�����·�����Ӧ���ɻ���̬�������˹��̵�������ȷ��
B����ҵ����������ʱ�����õ��dz�ѹ����ѹ��ת�����Ѿ��ܸߣ���B����
C����ⱥ��ʳ��ˮ������������������������������C����
D��֧�����ѱ�ϸ�������ʹˮ����Ⱦ����D����
E���Ȼ������ǿ�������Σ�ˮ�������ԣ�����ʴ�豸����E��ȷ��
F��������������ǿ�Ļ�ԭ�ԣ����ױ���������F��ȷ��
G������������ָ�����õ糡�����ã�ǿ�н�������缫����������ʹ�缫�м䲿λŨ�ȴ�Ϊ�½����Ӷ��Ƶõ�ˮ�ķ�������G��ȷ��
H����ˮ��þ�������ǣ���ˮ����±ˮ������Ӧ�ۡ�����ʯ�����Mg��OH��2���������MgCl2•6H2O��MgCl2���������MgCl2��Mg��Cl2����H��ȷ��
I��̼��ѧ�ĸ���Է�����ֻ��һ��̼ԭ�ӵĻ�����Ϊԭ�����ϳɻ���ԭ�Ϻ�ȼ�ϵĻ�ѧ��-̼��ѧ����I��ȷ��
J����ѧ���������������ʯ��Ĥ��ԭ��Ϊ��CH4$\stackrel{һ��������}{��}$C�����ʯ��+2H2����J��ȷ��
K������ʹ�õ���ʯ�ң���ʯ�������ֵ�������֮һ����K����
L��������ڵ���������ȡ������L����
�����ѡ��Ϊ��B��C��D��K��L��
�ʴ�Ϊ��B��C��D��K��L��
��2���۱�ϩ�����DZ�ϩ���ƼӾ۷�Ӧ�IJ������Ϊ��ϩ���ƣ��ṹ��ʽΪ��CH2=CHCOONa��
�ʴ�Ϊ��CH2=CHCOONa��
��3�����������������Ӧ��Br2+SO2+2H2O�TH2SO4+2HBr�������������ᶼ��ǿ�ᣬ���Թ�ҵ������Ӧ�������Ҫ�����Ƿ�Ӧ����������ǿ�ᣬ��ʴ�豸��
�ʴ�Ϊ��Br2+SO2+2H2O=4H++SO42-+2Br-��ǿ����豸�����ظ�ʴ��
��4������SiCl4��H2��O2��Ӧ�����������֣����ά����Ҫ�ɷ���SiO2��H��ClԪ�ر�����һ�����У�H��ClԪ�ؽ�ϳ�HCl��Ȼ����ƽ���ɣ�
�����Ļ�ѧ����ʽΪ��SiCl4+2H2+O2$\frac{\underline{\;����\;}}{\;}$SiO2+4HCl��
�ʴ�Ϊ��SiCl4+2H2+O2$\frac{\underline{\;����\;}}{\;}$SiO2+4HCl��
���� ��ʼʱ���������ʵ���Ϊn����Ӧ���������������ʵ���Ϊ2x����
��3SiCl4��g��+2H2��g��+Si��s�� 4SiHCl3��g��
4SiHCl3��g��
��ʼ����mol�� n 0
�仯����mol�� 2x 4x
ƽ������mol�� n-2x 4x
4x=0.020mol/L��20L=0.4mol��x=0.1mol��
n-2x=0.140mol/L��20L=2.8mol��n=3.0mol��
��2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2NaOH��
2��58.5 1
m��NaCl�� 3.0mol
m��NaCl��=2��58.5��3.0=351g��
�ʴ�Ϊ��351g��
��5����NaClת��ΪNaClO3��ʧȥ������Ϊ6��H2Oת��ΪH2���õ��ĵ�����Ϊ2���������H2���ΪVL�����ݵ�ʧ�����غ��֪��
$\frac{213g}{106.5g/mol}$��6mol=$\frac{V}{22.4L/mol}$��2
��ã�V=134.4L��
�ʴ�Ϊ��134.4��
���� ����Ϊ�ۺ��⣬�漰֪ʶ��dz��࣬��Ŀ�ѶȽϴ��״���Ϊ��4����5���⣬��ȷ���ԭ�������������ԭ��Ӧ���ɼ��ɽ��ע�����֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���� | ���� |
| A | ��ϩ�ֱ�ͨ�����Ը�����غ�������Ȼ�̼�� Һ������Һ����ɫ | ��������Ӧ������ͬ |
| B | ��֬�����ǡ������ʶ���ˮ�� | ���߶�����Ȼ�߷��ӻ����� |
| C | �Ҵ������ᶼ�ܺ��Ʒ�Ӧ | ���ߵĽṹ�ж������ǻ� |
| D | �����Ǻ���ȩ���ܺ����Ƶ�������ͭ��Ӧ | ���ߵĽṹ�ж�����ȩ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
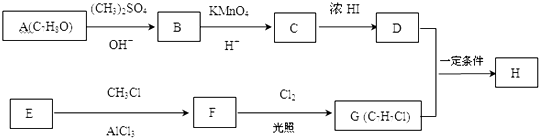
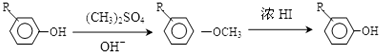
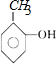 ����C����D�Ļ�ѧ����ʽΪ
����C����D�Ļ�ѧ����ʽΪ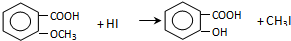 ��
��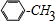 +Cl2$\stackrel{����}{��}$
+Cl2$\stackrel{����}{��}$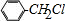 +HCl����Ӧ����Ϊȡ����Ӧ
+HCl����Ӧ����Ϊȡ����Ӧ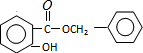 ��
�� ����
����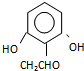 ����
����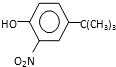 ����Ӧ����1���õ��Լ�Ϊ��CH3��3CCl/AlCl3��K�Ľṹ��ʽΪ
����Ӧ����1���õ��Լ�Ϊ��CH3��3CCl/AlCl3��K�Ľṹ��ʽΪ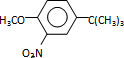 ����Ӧ����3���õ��Լ�ΪŨHI��
����Ӧ����3���õ��Լ�ΪŨHI��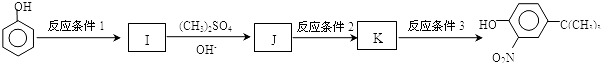
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PM2.5��ָ������ֱ����2��5�Ŀ�����Ҳ��Ϊ����ο����������Σ���������Ϊ������ֱ�ӽ������ | |
| B�� | ��������Ϊ�����ŷ�β���������ŷŷ�����ȼ���̻�������⿵�ԭ������ɵ� | |
| C�� | ��ʯ��Դ��������������������ȼ�չ����л����Ⱦ�������ʣ����Ӧ����ʹ�û�ʯ��Դ���������ɫ��ѧ�ĺ��� | |
| D�� | ��ú����������Һ��������ȴ�����������������������ʣ����ҿ��Խ��ͶԻ�������Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HA��Һ�ĵ����Ա�ǿ���� | |
| B�� | 10 mL 1 mol/L��HA��Һ��10 mL 1 mol/L��NaOH��Һǡ����ȫ��Ӧ | |
| C�� | NaA��Һ��pH��7 | |
| D�� | 0.1 mol/L HA��Һ��pH=1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ߵ����ʵ�����ȫȼ�����ĵ��������� | |
| B�� | ���߷�������ԭ�Ӷ�����ͬһ��ƽ���� | |
| C�� | �������ת���ҷ�Ӧ���ڿ��淴Ӧ | |
| D�� | ���߿������Ը��������Һ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com