
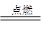 2CO2 2H2+O2
2CO2 2H2+O2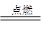 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O| | 乙烷 | 丙烷 | 丁烷 |
| 熔点/℃ | -183.3 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
 O2(g)=CO2(g)ΔH2=-283 kJ/mol
O2(g)=CO2(g)ΔH2=-283 kJ/mol O2(g)=CO(g)ΔH3=?
O2(g)=CO(g)ΔH3=?| A.CO的燃烧热为283 kJ/mol |
| B.二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C.ΔH3=ΔH2-ΔH1=110.5 kJ/mol |
| D.ΔH3=ΔH1-ΔH2=-110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢氧化钾与硫酸的反应 |
| B.锌与盐酸反应放出氢气 |
| C.镁条在空气中燃烧 |
| D.Ba(OH)2·8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-2.92 kJ·mol-1 |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-1 |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-73 kJ·mol-1 |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-0.72 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.C(s)+ O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该过程是将太阳能转化为化学能的过程 |
| B.催化剂a表面发生氧化反应,有O2产生 |
| C.催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D.催化剂b表面的反应是CO2+2H++2e-=HCOOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.I2(g)=I2(s) ΔH=-17.00 kJ/mol |
| C.固态碘的稳定性比气态碘的稳定性高 |
| D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com