
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
分析 (1)通过图表数据分析第三组实验数据表明,硫酸完全反应,有关化学方程式为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可见无论硫酸发生那个反应都有关系式H2SO4~SO2,n(SO2)=n(H2SO4)=$\frac{2.688L}{22.4L/mol}$=0.12mol,c=$\frac{n}{V}$;
(2)n(s)=0.1mol,则根据化学方程式Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可知n(Na2S2O3)=0.1mol,m(Na2S2O3 •5H2O)=24.8g,生成二氧化硫气体物质的量为0.1mol,由Na2SO3生成的二氧化硫物质的量=0.12mol-0.1mol=0.02mol,n(Na2SO3)=0.02mol,m(Na2SO3)=0.02mol×126g/mol=2.52g,由于m(Na2S2O3 •5H2O)+m(Na2SO3)=24.8g+2.52g=27.32g<35.00g,所以固体中含有Na2SO4;
(3)通过图表数据分析第三组实验数据可知,30ml的硫酸恰好与样品完全反应时固体质量为30.16g,因此0<a<0.03时,硫酸不足量,放出气体体积依据硫酸计算,b=(2.688L+0.03)×a=89.6a;若a≥0.03,硫酸过量样品完全反应,产生气体体积b=2.688.
解答 解:(1)通过图表数据分析第三组实验数据表明,硫酸完全反应,有关化学方程式为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可见无论硫酸发生那个反应都有关系式H2SO4~SO2,n(SO2)=n(H2SO4)=$\frac{2.688L}{22.4L/mol}$=0.12mol,c=$\frac{n}{V}$=$\frac{0.12mol}{0.03L}$=4mol/L;
答:所用硫酸溶液的物质的量浓度4mol/L;
(2)n(s)=0.1mol,则根据化学方程式Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可知n(Na2S2O3)=0.1mol,m(Na2S2O3 •5H2O)=24.8g,生成二氧化硫气体物质的量为0.1mol,由Na2SO3生成的二氧化硫物质的量=0.12mol-0.1mol=0.02mol,n(Na2SO3)=0.02mol,m(Na2SO3)=0.02mol×126g/mol=2.52g,由于m(Na2S2O3 •5H2O)+m(Na2SO3)=24.8g+2.52g=27.32g<35.00g,所以固体中含有Na2SO4,选d;
故答案为:d;
(3)通过图表数据分析第三组实验数据可知,30ml的硫酸恰好与样品完全反应时固体质量为30.16g,因此0<a<0.03时,硫酸不足量,放出气体体积依据硫酸计算,b=(2.688L+0.03)×a=89.6a;若a≥0.03,硫酸过量样品完全反应,产生气体体积b=2.688;4
答:当加入硫酸的体积(a L)在不同取值范围时,生成SO2体积(b L,标态)的值,0<a<0.03时b=89.6a,a≥0.03时b=2.688.
点评 本题考查了物质组成的探究分析,数据分析判断,反应产物和反应过程的理解应用,掌握题干信息是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
 )加氢产物1,2-二甲基环乙烷(
)加氢产物1,2-二甲基环乙烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 操作及现象 |
| A | Ca(OH)2溶液 | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. |
| B |  溶液 溶液 | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. |
| C | Ca(ClO)2溶液 | 通入CO2,溶液没有明显变化.再滴入品红溶液,红色褪去. |
| D | CaCl2溶液 | 通入CO2,溶液没有明显变化.若同时通入CO2和NH3,则溶液变浑浊. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl水溶液的导电性很弱,所以AgCl是弱电解质 | |
| B. | 所有盐类都能促进水的电离 | |
| C. | 碳酸钠溶液加水稀释过程中,溶液中各离子浓度都减小 | |
| D. | 将1 mL pH=3的HX溶液稀释到10 mL,若溶液的pH<4,则HX为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的分子式是CH4,是H元素质量分数含量最高的烃 | |
| B. | 甲烷中最多三个原子共面 | |
| C. | CCl4可由CH4制得,CCl4可萃取碘水中的碘 | |
| D. | 1 mol甲烷和氯气光照充分反应,最多消耗2mol氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
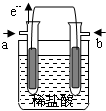 某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )| A. | a为负极,通入的气体为氢气 | |
| B. | 正极的电极反应式为:Cl2+2e-=2Cl- | |
| C. | 电流由b极流出,经外电路到a极 | |
| D. | 原电池内部,H+移向负极,Cl-移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物含碳.氢.氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳.氢原子个数之比是2:3 | |
| D. | 该有机物含2个碳原子,6个氢原子,但不能确定是否含氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com