
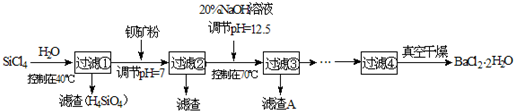
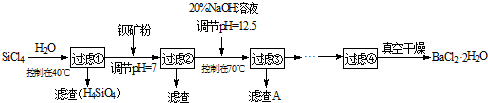
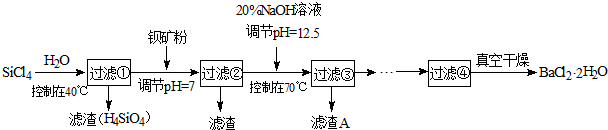
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:

已知:
①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为_______________________________________
(2)用H2还原SiCl4蒸汽可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反 应的热化学方程式为_____________________________________________
(3)加钡矿粉并调节pH=7的目的是① ,②
(4)过滤②后的滤液中Fe3+浓度为 (滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)
(5)生成滤渣A的离子方程式__________________________________________
(6)列式计算出10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量为多少吨?
(14分,第2、6问各3分,其他各2分)(1)SiCl4+4H2O=H4SiO4↓+4HCl
(2)SiCl4(s)+2H2(g)=Si(s)+4HCl(s) △H=+236kJ/mol
(3)使BaCO3转化为BaCl2;使Fe3+完全沉淀 (4)2.2×10-17mo/L
(5)Mg2++2OH-=Mg(OH)2↓ (6)=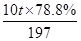 ×244=9.76t
×244=9.76t
【解析】
试题分析:(1)氯化硅水解生成原硅酸和氯化氢,水解方程式为SiCl4+4H2O=H4SiO4↓+4HCl。
(2)在反应中硅元素的化合价从+4价降低到0价,得到4个电子。当反应中有1mol电子转移时吸收59KJ热量,则消耗1mol氯化硅是吸收的热量是59kJ×4=236kJ,因此该反应的热化学方程式为SiCl4(s)+2H2(g)=Si(s)+4HCl(s) △H=+236kJ/mol。
(3)pH=3.4时,三价铁离子完全生成沉淀;盐酸和碳酸钡反应生成氯化钡和二氧化碳、水,所以加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2,同时使Fe3+完全沉淀。
(4)溶液的pH=7,则溶液中 c(OH-)=1×10-7mo/L,则共计氢氧化铁的溶度积常数可知,滤液中Fe3+浓度=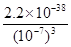 =2.2×10-17mo/L。
=2.2×10-17mo/L。
(5)由于滤液中还含有镁离子,所以需要调节溶液的pH=12.5,使镁离子完全沉淀生成氢氧化镁,反应的离子方程式是Mg2++2OH-=Mg(OH)2↓
(6)根据钡原子守恒可知,10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量为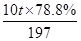 ×244=9.76t。
×244=9.76t。
考点:考查制备实验方案的设计;热化学方程式的书写;难溶电解质的溶解平衡及沉淀转化的计算;物质制备的计算等


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省四地六校高三第三次月考化学试卷(解析版) 题型:实验题
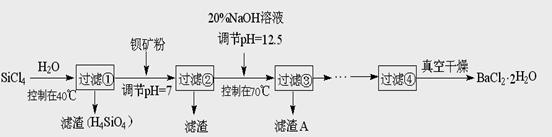
(12分)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2.2H2O,工艺流程如下:
已知:
①常温下Fe3+、Mg2+完全沉淀的PH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2.2H2O的相对分子质量是244
回答下列问题:
⑴SiCl4发生水解反应的化学方程式_______________________________________
⑵SiCl4用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反应的热化学方程式为_____________________________________________
⑶加钡矿粉调节PH=7的作用是①使BaCO3转化为BaCl2 ②_______________________
⑷生成滤渣A的离子方程式__________________________________________
⑸BaCl2滤液经______、________、过滤、_________,再经真空干燥后得到BaCl2.2H2O
⑹10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2.2H2O___________吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com