
 重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )
重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )| A. | 该有机物的分子式为C15H22O4 | |
| B. | 1mol该有机物与足量Na反应生成1molH2 | |
| C. | 该有机物能发生取代、加成和水解反应 | |
| D. | 1mol该有机物与足量溴反应最多消耗4molBr2 |
分析 由结构可知分子式,分子中含C=O、C=C、-OH、-COOH,结合烯烃、醇、羧酸的性质来解答.
解答 解:A.由结构简式可知,其分子式为C15H20O4,故A错误;
B.-COOH、-OH与Na反应,则1mol该有机物与足量Na反应生成1molH2,故B正确;
C.分子中含1个C=O和3个C=C,可发生加成反应,含-OH可发生消去反应,但不能发生水解反应,故C错误;
D.只有3个碳碳双键与溴水发生加成反应,则1mol该有机物与足量溴反应最多消耗3molBr2,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重烯烃、醇、羧酸等有机物性质的考查,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:填空题

滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 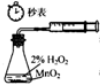 装置测定化学反应速率 | B. | 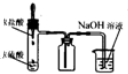 装置制取并吸收HCl | ||
| C. |  装置制备纯净NH3 | D. | 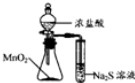 装置比较MnO2、Cl2、S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 14种 | C. | 16种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
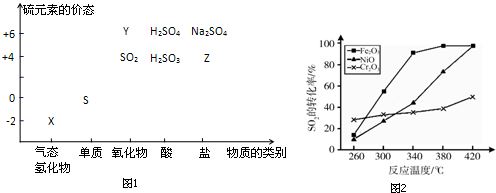
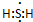 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极区溶液的pH减小 | |
| B. | 该电用电可用稀H2SO4代替KOH溶液 | |
| C. | 充电时,电解质溶液中的K+等阳离子向Zn电极移动 | |
| D. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com