
【题目】亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)=_____________(用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8(mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq)![]() AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为____________。
㈡NaNO2性质探究
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
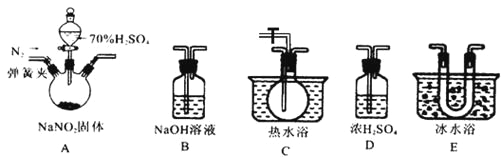
已知: 气体液化的温度:NO221℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→______→ ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
【答案】NO2-+H2O![]() HNO2+OH- c(OH-)-c(H+) 111.1 5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O D E C B 检验装置的气密性 打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO ;若无红棕色气体出现,则不含NO 冷凝,使NO2完全液化 4NO2+O2+4NaOH=4NaNO3+2H2O
HNO2+OH- c(OH-)-c(H+) 111.1 5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O D E C B 检验装置的气密性 打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO ;若无红棕色气体出现,则不含NO 冷凝,使NO2完全液化 4NO2+O2+4NaOH=4NaNO3+2H2O
【解析】
(一)(1)NaNO2溶液显示碱性,NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;根据亚硝酸钠溶液中的质子守恒分析;
(2)写出该反应的平衡常数表达式,然后根据Ksp(AgNO2)、Ksp(AgCl)进行计算;
(3)酸性高锰酸钾具有强氧化性,将亚硝酸根离子氧化成硝酸根离子;
(二)(1)根据各部分装置的作用进行连接;
(3)①根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断;
②温度低于二氧化氮液化温度时,二氧化氮变成液态;
③氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水。
(一)(1)由于NaNO2溶液显示碱性,说明NaNO2为强碱弱酸盐,NO2-在溶液中存在水解平衡,NO2-+H2O![]() HNO2+OH-;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+)。
HNO2+OH-;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+)。
(2)反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=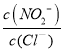 ,根据Ksp(AgCl)=c(Cl-)×c(Ag+)、Ksp(AgNO2)=c(NO2-)×c(Ag+)可知,K=
,根据Ksp(AgCl)=c(Cl-)×c(Ag+)、Ksp(AgNO2)=c(NO2-)×c(Ag+)可知,K= 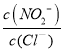 =
=![]() =
=![]() =111.1;
=111.1;
(3)酸性高锰酸钾具有强氧化性,能够将亚硝酸钠氧化成硝酸钠,根据得失电子守恒和原子守恒配平,反应的离子方程式为5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O;
(二)(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用检验NO,所以装置的连接为:A→D→E→C→B;组装好仪器后,接下来进行的操作实验是检查装置气密性。
(3)①确认A中产生气体是否含有NO的方法为:打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO;若无红棕色气体出现,则不含NO。
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,所以装置E的作用是冷凝使NO2完全液化。
③如果向D中通入过量O2,则装置B中二氧化氮、氧气和氢氧化钠反应生成硝酸钠和水,其反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】邻硝基甲苯和对硝基甲苯能被用作爆炸品检测的示踪剂。某探究小组利用下图反应和装置制备一硝基甲苯。
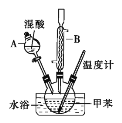
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:
①按体积比1∶3配制浓硫酸与浓硝酸的混合物80mL;②在250mL的三颈烧瓶中加入30mL(26g)甲苯,按图所示装好药品和其他仪器;③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);④控制温度约为50℃,反应大约10min,三颈烧瓶底有大量淡黄色油状液体出现;⑤分离出一硝基甲苯的总质量为27.20g。
请回答下列问题:
(1)使用仪器A前必须进行的操作是_______。
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、_______。
(3)配制混酸的方法是分别量取20mL浓硫酸和60mL浓硝酸,将浓_______倒入烧杯中,浓_______沿着烧杯内壁缓缓注入,并不断搅拌。
(4)控制温度约为50℃时,反应生成的产物一硝基甲苯是邻硝基甲苯和对硝基甲苯混合物,写出该反应生成对硝基甲苯的化学方程式_______。
(5)分离反应后产物的方案如下:

①操作1的名称为_______。
②操作2中,下列仪器选择及安装正确的是_______(填字母)。
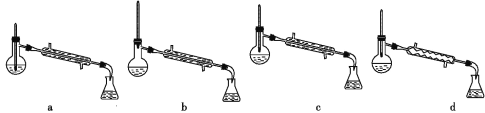
(6)该实验中一硝基甲苯的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是( )
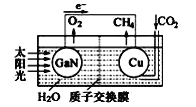
A.该装置中GaN为负极
B.电池工作时H+向Cu电极移动
C.Cu电极的电极反为: CO2+8e-+8H+═CH4+2H2O
D.该装置中涉及的能量转化形式只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华优秀传统文化涉及到很多的化学知识,下列有关说法错误的是
A.“日照澄洲江雾开”中伴有丁达尔效应
B.古剑“沈卢”以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
C.“粉身碎骨浑不怕,要留清白在人间”指的是物质发生了物理变化
D.“煤饼烧蛎房成灰![]() 蛎房即牡蛎壳
蛎房即牡蛎壳![]() ”中灰的主要成分为碳酸钙
”中灰的主要成分为碳酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
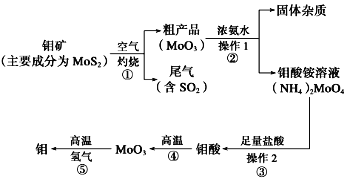
(1)写出在高温下发生反应①的化学方程式______________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:________________________________
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_______________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
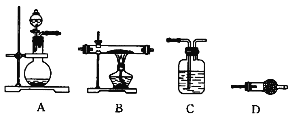
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是___________
② 在烧瓶A中加入少量硫酸铜的目的是____________________________
③ 两次使用D装置,其中所盛的药品依次是____________________、______________________
(5)工业上制备还原性气体CO和H2的反应原理为CO2 + CH4![]() 2CO + 2H2 CH4 + H2O
2CO + 2H2 CH4 + H2O![]() CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑧ | ⑩ | |||||
三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
四 | ② | ④ |
(1)在这10种元素中,化学性质最不活泼的元素是________ (写序号),得电子能力最强的原子是________ (用元素符号表示);元素⑦的最高价氧化物对应的水化物是________________ (写化学式)。
(2)元素④的离子结构示意图为________________。
(3span>)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ________________。
(4)请写出:
(i)③的单质置换出⑥的单质的化学方程式: ________________________。
(ii)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为____________________。
(iii)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如下图所示:
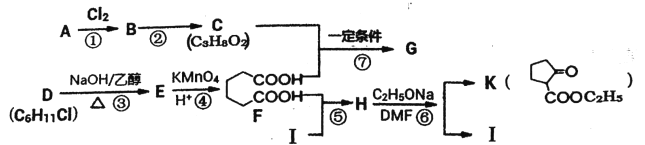
已知:①气态链烃A在标准状况下的密度为1.875g·L-1;
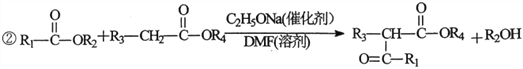
(1)B的名称为__________;E的结构简式为__________。
(2)下列有关K的说法正确的是__________。
A.易溶于水,难溶于CCl4
B.分子中五元环上碳原子均处于同一平面
C.能发生水解反应加成反应
D.1molK完全燃烧消耗9.5molO2
(3)⑥的反应类型为__________;⑦的化学方程式为__________
(4)与F官能团的种类和数目完全相同的同分异构体有__________种(不含立体结构),其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备![]()
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列叙述不正确的是
A.![]() 本草纲目
本草纲目![]() 中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载,“浣衣”过程中涉及水解反应
中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载,“浣衣”过程中涉及水解反应
B.![]() 本草衍义
本草衍义![]() 中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是干馏
中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是干馏
C.![]() 梦溪笔谈
梦溪笔谈![]() 中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁合金,硬度比纯铁大
中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁合金,硬度比纯铁大
D.![]() 淮南万毕术
淮南万毕术![]() 对湿法冶金术的记载:“曾青得铁则化为铜”,文中涉及置换反应
对湿法冶金术的记载:“曾青得铁则化为铜”,文中涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
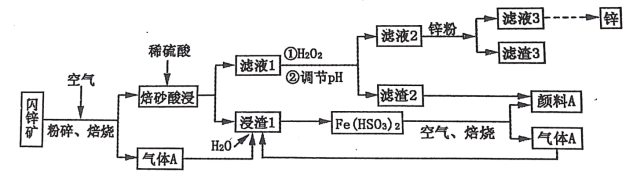
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com