
【题目】氢能是理想的清洁能源,资源丰富。以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:

(1)过程I :2Fe3O4(s)![]() 6FeO(s)+O2(g) △H=+313.2 kJ/mol
6FeO(s)+O2(g) △H=+313.2 kJ/mol
①过程I需要将O2不断分离出去,目的是______________。
②一定温度下,在容积可变的密闭容器中,该反应已达到平衡。下列说法正确的是____(填字母标号) 。
a.容器内气体密度和相对分子质量都不再改变
b.升高温度,容器内气体密度变大
c.向容器中通入N2,Fe3O4 转化率不变
d.缩小容器容积,O2(g)浓度变大
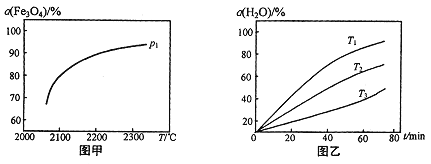
③在压强p1下,Fe3O4的平衡转化率随温度变化的曲线如图甲所示。若将压强由p1增大到p2在图甲中画出p2的α(Fe3O4)~T 曲线示意图。___________
(2)已知H2的燃烧热是285.8kJ/mol,则液态水通过过程II转化的热化学方程式为______。
(3)其他条件不变时,过程II在不同温度下,H2O的转化率随时间的变化α(H2O)~t曲线如图乙所示,温度T1、T2、T3由大到小的关系是_________,判断依据是_________。
(4)科研人员研制出透氧膜(OTM),它允许电子和O2-同时透过,可实现水连续分解制H2,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示:
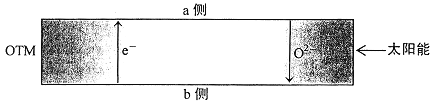
CO 在________侧反应(填“a”或“b”),另一侧的电极反应式为______________。
【答案】提高Fe3O4的转化率 ab  3FeO(s)+ H2O(l)=H2(g)+ Fe3O4(s) △H =+129.2kJ/mol Tl>T2>T3 其他条件相同时,图像斜率Tl>T2>T3,即反应速率Tl>T2>T3,而温度越高,反应速率越快,所以Tl>T2>T3 b H2O+2e-=H2+O2-
3FeO(s)+ H2O(l)=H2(g)+ Fe3O4(s) △H =+129.2kJ/mol Tl>T2>T3 其他条件相同时,图像斜率Tl>T2>T3,即反应速率Tl>T2>T3,而温度越高,反应速率越快,所以Tl>T2>T3 b H2O+2e-=H2+O2-
【解析】
(1)过程Ⅰ:2Fe3O4(s)6FeO(s)+O2(g)△H=+313.18kJmol-1。
①将O2分离出去,平衡正向移动,目的是提高Fe3O4的转化率,故答案为:提高Fe3O4的转化率;
②a.容器内只有氧气,温度不变,平衡常数不变,氧气的浓度不变,则平衡时气体密度和相对分子质量不变,正确;b.正反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,氧气的浓度增大,相当于体积减小,容器内气体密度变大,正确;c.向容器中通入N2,容器的体积增大,氧气的浓度减小,平衡正向移动,Fe3O4转化率增大,错误;d.温度不变,平衡常数不变,缩小容器容积,O2(g)浓度不变,错误;故选ab;
③压强增大,平衡向气体系数减小的方向移动,平衡逆向移动,Fe3O4的转化率降低,所以图像为: ,故答案为:
,故答案为: ;
;
(2)由图可知:过程Ⅱ的化学方程式是氧化亚铁与水反应生成四氧化三铁和氢气,所以反应方程式为:3FeO+H2OFe3O4+H2,过程Ⅰ:①2Fe3O4(s)6FeO(s)+O2(g)△H=+313.18kJmol-1,H2的燃烧热是285.8kJ/mol,即②H2(g)+![]() O2(g)=H2O(l) △H=—285.8kJ/mol,根据盖斯定律,将(①×
O2(g)=H2O(l) △H=—285.8kJ/mol,根据盖斯定律,将(①×![]() +②)×-1得:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol,故答案为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol;
+②)×-1得:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol,故答案为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol;
(3)T1>T2>T3;初始压强相同,浓度相同,图像斜率T1>T2>T3,温度越高,反应速率越大,则说明T1>T2>T3,故答案为:T1>T2>T3;其他条件相同时,图像斜率Tl>T2>T3,即反应速率Tl>T2>T3,而温度越高,反应速率越快,所以Tl>T2>T3;
(4)本实验利用水制取氢气,H2O得电子生成H2和O2-,O2-通过OTM进入b侧,所以H2O在a侧,CO在b侧反应,a侧的电极反应式为H2O+2e-=H2+O2-,故答案为:b;H2O+2e-=H2+O2-。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。

①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酸雨的说法不正确的是( )
A. 空气中的SO2溶于水,最终形成酸雨
B. NO2或SO2都会导致酸雨的形成
C. pH<7的雨水不都是酸雨
D. 工业废水任意排放是造成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如图,下列说法不正确的是
![]()
A. 分子式为C8H7OCl
B. 在同一平面上的碳原子最多有8个
C. 1摩尔苯氯乙酮最多可与3摩尔氢气发生加成反应
D. 不存在与它同一类别的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用正催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大容器内的压强
A.②③B.②③④⑥C.②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1923年,在汉阳兵工厂工作的我国化学家吴蕴初先生研制出了廉价生产味精的方案,并于1926年向英、美、法等化学工业发达国家申请专利。这也是历史上,中国的化学产品第一次在国外申请专利。以下是利用化学方法合成味精的路线:
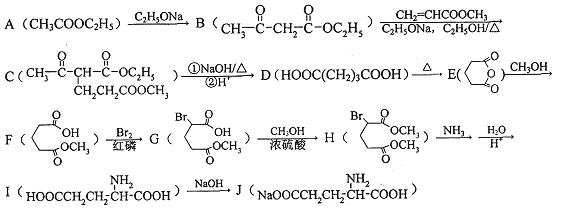
请回答下列问题:
(1)下列有关氨基酸的说法正确的是_______(填字母标号)。
A.氨基酸是组成蛋白质的基本结构单位 B.氨基酸都是α—氨基酸
C.氨基酸都有两性 D.氨基酸都难溶于水
(2)化合物I的化学名称为___________。
(3)F中官能团的名称为__________;由B生成C的反应类型___________。
(4)写出由A生成B的化学方程式___________。
(5)符合下列要求的B的同分异构体共有20种。写出任意两种的结构简式为____________。
①结构中含有六元环
②能在NaOH溶液中发生水解反应
③lmol该物质与足量金属Na反应能够生成0.5molH2
(6)参照上述合成路线,写出以丙酸(CH3CH2COOH)和甲醇为原料(其他无机试剂任选),合成丙氨酸(![]() )的线路。_____________
)的线路。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.碳酸铵分解是吸热反应,根据焓判据判断能自发分解
B.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大,越混乱,熵值越大
C.水总是自发地由高处往低处流,这是一个自发反应
D.室温下水结成冰是自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com