
为了探究金属腐蚀的条件和速率,某课外小组学生用不同金属丝将三根大小相同的铁钉分别固定在图示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结束时现象的描述不正确的是
A.实验结束时,装置Ⅰ左侧的液面一定会下降
B.实验结束时,装置Ⅰ一定比装置Ⅱ左侧液面低
C.实验结束时,装置Ⅱ中的铁钉腐蚀最严重
D.实验结束时,装置Ⅲ中的铁钉几乎没被腐蚀
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.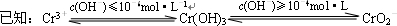 ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是 ;
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。
|
|
① FeSO4还原Cr2O72-的离子方程式为 。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为 。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
④ 下列关于铬及其化合物的说法中正确的是 。
a.K2Cr2O7是一种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
d.金属铬硬度大、耐腐蚀,是常用的镀层金属
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
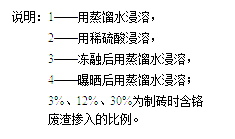

我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得出多个结论:
① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可): ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.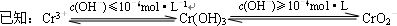 ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______.查看答案和解析>>
科目:高中化学 来源:2009年江苏省淮安市金湖中学高考化学模拟试卷(解析版) 题型:解答题
 ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com