


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
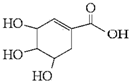
| A、莽草酸的分子式为C7H12O5 |
| B、莽草酸既能发生加聚反应,又能发生缩聚反应 |
| C、能用溴水区分莽草酸、苯和四氯化碳 |
| D、莽草酸能发生消去反应、取代反应、氧化反应、加成反应、酯化反应和还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
| B、不锈钢餐具和温度计中的水银都属于合金 |
| C、福岛核电站泄漏的放射性物质131I和127I互为同素异形体,化学性质几乎相同 |
| D、绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、决定化学反应速率的主要因素是温度 |
| B、反应速率用于衡量化学反应进行快慢 |
| C、可逆反应达到平衡状态时正逆反应的速率都为0 |
| D、增大反应物的量或提高反应温度一定能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
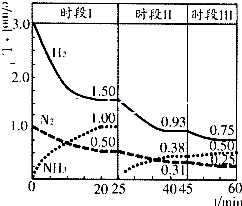 N2(g)+3H2(g)?2NH3(g)△H=-92.2kJmol-1.在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示.下列说法错误的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.2kJmol-1.在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示.下列说法错误的是( )| A、前25min内反应放出的热量为46.1kJ |
| B、第25min改变的条件是将NH3从反应体系中分离出去 |
| C、若第60min时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D、若时段I中投入物质的浓度为原来的2倍,则反应物的转化率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mL 0.3mol?L-1 Na2CO3 |
| B、10mL 0.4mol?L-1 Na2CO3 |
| C、25mL 0.4mol?L-1 Na2CO3 |
| D、15mL 0.5mol?L-1 Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com