
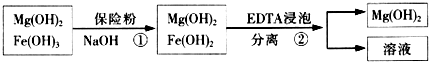
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
分析 (1)氢氧化镁和盐酸反应产生氯化镁和水,根据元素守恒和电荷守恒书写离子方程式;
(2)Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ•mol-1 ①
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H2=242kJ•mol-1②
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1③
根据盖斯定律可知,将方程式③+②-①得氢氧化镁分解的热化学方程式;
(3)保险粉(Na2S2O4)具有还有性,可以将氢氧化铁还原为氢氧化亚铁;
(4)Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动;
(5)观察实验2、3知,其它条件相同时,温度不同,铁含量相同,采取低温能抑制氢氧化镁的溶解,所以采用低温较好,选40℃,观察实验3、4知,其它条件相同时,EDTA质量越大,含铁量越低,所以选取EDTA质量为0.10g,观察实验1、2知,其它条件相同时,保险粉质量越大,含铁量越低,所以选取保险粉质量为0.10g,据此答题;
解答 解:(1)氢氧化镁和盐酸反应产生氯化镁和水,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(2)Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ•mol-1 ①
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H2=242kJ•mol-1②
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1③
根据盖斯定律可知,将方程式③+②-①得:Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol,
故答案为:Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol;
(3)保险粉(Na2S2O4)可以将氢氧化铁还原为氢氧化亚铁,发生的离子方程式为:6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O,
故答案为:将氢氧化铁还原为氢氧化亚铁;
(4)Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解,
故答案为:Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解;
(5)观察实验2、3知,其它条件相同时,温度不同,铁含量相同,采取低温能抑制氢氧化镁的溶解,所以采用低温较好,选40℃,观察实验3、4知,其它条件相同时,EDTA质量越大,含铁量越低,所以选取EDTA质量为0.10g,观察实验1、2知,其它条件相同时,保险粉质量越大,含铁量越低,所以选取保险粉质量为0.10g
故选C.
点评 本题考查了物质制备实验方法,物质组成的计算应用,氧化还原反应的电子转移计算,镁、铝及其化合物性质的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若铁粉有剩余,则不溶物中一定有铜 | |
| B. | 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+ | |
| C. | 若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+ | |
| D. | 若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3+6HCl═3Cl2↑+KCl+3H2O反应中还原剂与氧化剂的物质的量之比为6:1 | |
| B. | 硝酸铵受热分解的化学方程式为:5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为5:3 | |
| C. | 工业上制备新型净水剂高铁酸钾(K2FeO4)的一步反应如下:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,若有2 mol FeCl3发生反应,转移电子的物质的量为6 mol | |
| D. | 氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成,方程式中AlN中氮的化合价为-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2仅是还原产物 | |
| B. | Cu(IO3)2既是氧化剂又是还原剂 | |
| C. | 氧化产物与还原产物物质的量比为13:2 | |
| D. | 当1 mol氧化剂参加反应时,被氧化的物质的物质的量为11mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | Na2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2-Cl | B. | 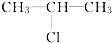 | C. | CH3CH2CH2-Br | D. | 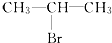 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物之间在化学性质上相似 | |
| B. | 同系物之间的物理性质随分子里碳原子数的递增,呈规律性的变化 | |
| C. | 同系物不可能是同分异构体 | |
| D. | 分子组成相差一个或几个CH2原子团的物质互称为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12mol2•L-2 | B. | 16mol2•L-2. | C. | 20mol2•L-2 | D. | 25mol2•L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com