
| A. | 气体甲、沉淀甲一定为纯净物 | |
| B. | CO32-、Al3+、K+一定不存在 | |
| C. | SO42-、NH4+一定存在,NO3-、Cl-可能不存在 | |
| D. | 若含有Fe3+,则一定含有Cl- |
分析 某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等,向溶液X中加过量的硫酸,有气体乙产生,发生的反应可能是CO32-与H+的反应,也可能是NO3-在H+条件下与Fe2+的氧化还原反应;
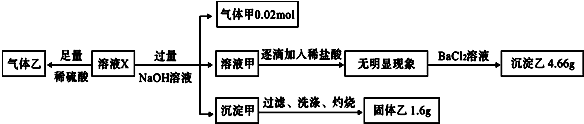
溶液X与过量的NaOH溶液反应生成气体甲为0.02mol,则气体甲为NH3,故溶液中含0.02molNH4+;所得的溶液甲中逐滴加入稀盐酸,无现象,故溶液X中无Al3+;再继续加氯化钡溶液,生成沉淀乙,则乙为BaSO4,质量为4.66g,则物质的量为0.02mol,即溶液X中含0.02molSO42-;所得沉淀甲应为Fe(OH)2或Fe(OH)3或两者均有,经过滤、洗涤灼烧后所得的固体乙为Fe2O3,质量为1.6g,则物质的量为0.01mol,故溶液X中含Fe2+或Fe3+或两者均有,且物质的量为0.02mol,然后根据离子之间的互斥性和溶液的电荷守恒来分析.
解答 解:某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等,向溶液X中加过量的硫酸,有气体乙产生,发生的反应可能是CO32-与H+的反应,也可能是NO3-在H+条件下与Fe2+的氧化还原反应;
溶液X与过量的NaOH溶液反应生成气体甲NH3为0.02mol,即溶液X中含0.02molNH4+;所得的溶液甲中逐滴加入稀盐酸,无现象,故溶液X中无Al3+;再继续加氯化钡溶液,生成沉淀乙,则乙为BaSO4,质量为4.66g,则物质的量为0.02mol,即溶液X中含0.02molSO42-;所得沉淀甲应为Fe(OH)2或Fe(OH)3或两者均有,经过滤、洗涤灼烧后所得的固体乙为Fe2O3,质量为1.6g,物质的量为0.01mol,故溶液X中含Fe2+或Fe3+或两者均有,且物质的量一定为0.02mol,由于Fe2+或Fe3+均能与CO32-发生双水解而不能共存,故溶液中无CO32-,则生成气体乙的反应只能是NO3-与Fe2+的氧化还原反应,故溶液中一定含Fe2+和NO3-,而所含阴离子的物质的量相等,即NO3-的物质的量也为0.02mol;
故现在溶液X中已经确定存在的离子是:阴离子:0.02molNO3-,0.02molSO42-,共带0.06mol负电荷;阳离子:0.02molNH4+,0.02molFe2+或Fe2+、Fe3+的混合物,所带的正电荷≥0.06mol,一定不含Al3+、CO32-,
根据溶液呈电中性可知,当 0.02mol全部是Fe2+时,阳离子所带正电荷为0.06mol,则Cl-可以存在,也可以不存在,若Cl-存在,则K+一定存在,若Cl-不存在,则K+一定不存在;
若溶液中含Fe3+,阳离子所带正电荷大于0.06mol,则溶液中一定存在Cl-,还可能存在K+.故溶液中可能含Cl-、K+.
A.气体甲为氨气,是纯净物,但沉淀甲可能是Fe(OH)2或Fe(OH)3或两者均有,不一定是纯净物,故A错误;
B.根据分析可知,K+可能存在,故b错误;
C.溶液中NO3-一定存在,故C错误;
D.由于溶液要保持电中性,故当溶液中含Fe3+时,则阳离子所带的正电荷>0.06mol,故溶液中一定含Cl-,故D正确;
故选D.
点评 本题考查了溶液中离子的检验,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题培养了学生的分析理解能力及逻辑推理能力.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| B. | 向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) | |
| C. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| D. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中加入AgNO3溶液得白色沉淀,加稀硝酸沉淀不消失,则原溶液一定存在Cl-或CO32- | |
| B. | 某无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸沉淀不溶解,则一定含有SO42- | |
| C. | 做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸 | |
| D. | 某无色溶液中滴加CaCl2溶液得白色沉淀,若加入盐酸则生成无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应已经停止 | B. | 逆反应速率为0 | ||
| C. | 体系温度不再改变 | D. | N2O5已全部转化为NO2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 配制480mLNaOH溶液需要的主要仪器有480mL容量瓶、玻璃棒、烧杯、量筒等 | |
| C. | 将固体药品放在蒸发皿中进行高温焙烧 | |
| D. | 冷凝管中冷却水的流向一定是下口进水、上口出水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
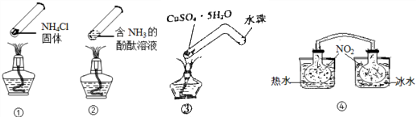
| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl易升华 | |
| B. | 加热时,②溶液颜色变,冷却后又恢复为原来的颜色 | |
| C. | 加热时,③中固体由蓝色变为白色,冷却后又恢复为原来的颜色 | |
| D. | ④中,浸泡在热水中的容器内气体颜色变深,说明受热时反应2NO2?N2O4向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有0.6NA个K+ | |
| B. | 1L溶液中含有K+和SO42-总数为0.9NA | |
| C. | 取出10mL该溶液中,K+浓度为0.3mol/L | |
| D. | 100mL溶液中含有SO42-数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com