
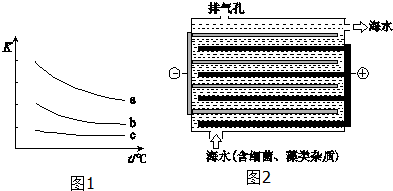
分析 Ⅰ.依据图象分析平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应;Cl2、Br2、I2,与H2反应时K与t的关系分析可知氯气和氢气反应放热多;
Ⅱ.(2)①电解饱和氯化钠溶液反应生成氢氧化钠、氯气和氢气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
②阴极生成氢气,水的电离被破坏电极附近生成氢氧化钠,氢氧化钠和碳酸氢钙,碳酸氢镁反应生成氢氧化镁、碳酸钙沉淀;
解答 解:Ⅰ.(1)图象分析平衡常数随温度升高减小,说明升温平衡逆向进行,逆反应为吸热反应,则正反应为放热反应,△H<0,
故答案为:<;
(2)Cl2、Br2、I2,与H2反应时K与t的关系分析可知氯气和氢气反应放热多,碘化氢加热分解平衡逆向进行平衡常数减小的大,同温度下,K越大,反应越完全,题目所给的卤族元素中,氯气与氢气反应是三者里最完全的,所以K最大,曲线a表示的是Cl2,
故答案为:Cl2;
Ⅱ.(2)①装置中由NaCl转化为NaClO的反应是电解氯化钠溶液生成氢氧化钠溶液、氯气和氢气,氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠和水,反应的化学方程式是:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;2NaOH+Cl2=NaClO+NaCl+H2O,
故答案为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;2NaOH+Cl2=NaClO+NaCl+H2O;
②阴极生成氢气,电极附近水的电离被破坏,电极附近生成氢氧化钠,氢氧化钠和碳酸氢钙,碳酸氢镁反应生成氢氧化镁、碳酸钙沉淀,氢氧化钠和碳酸氢钙反应生成CaCO3的沉淀产生水垢,生成碳酸钙沉淀的反应离子方程式是:Ca2++HCO3-+OH-=CaCO3↓+H2O,
答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O;
点评 本题考查了海水资源的分析应用,物质制备电解原理的分析应用图象分析应用,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
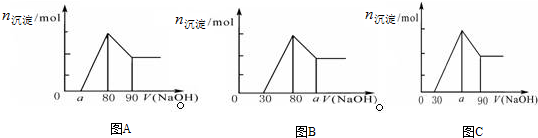
| A. | A图中a的取值范围为 0≤a<50 | |
| B. | A图中$\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、H+、Fe2+、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ④⑥ | C. | ③④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、AlO2-、Cl- | B. | Mg2+、Cu2+、SO42-、HCO3- | ||
| C. | Fe3+、Na+、SCN-、CO32- | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样品进行焰色反应,火焰显黄色,说明有Na元素存在,无K元素 | |
| B. | 向某溶液中滴入稀盐酸立即产生使澄清石灰水变浑浊的气体,说明有CO32-存在 | |
| C. | 向某溶液中滴入KSCN溶液不变色,再滴入几滴氯水变红,说明存在Fe2+,无Fe3+ | |
| D. | 向某溶液中滴加过量Ba(0H)2溶液,最终有白色沉淀,说明无Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2S和SO2的混合气体中含有的分子总数为NA | |
| B. | 1 L pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA | |
| C. | 78g苯中含有碳碳双键的数目为3NA | |
| D. | 6.72L NO2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com