
分析 混合溶液的pH=1,说明NaHSO4过量,混合溶液的pH=1,混合溶液中n(H+)=0.1mol/L×0.2L=0.02mol,二者反应方程式为Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4,根据Ba原子守恒计算n(BaSO4),根据m=nM计算沉淀质量;
H+和OH-反应实质为H++OH-=H2O,根据Ba(OH)2中n(OH-)计算消耗n(H+),根据H原子守恒计算硫酸氢钠浓度.
解答 解:混合溶液的pH=1,说明NaHSO4过量,混合溶液的pH=1,混合溶液中n(H+)=0.1mol/L×0.2L=0.02mol,二者反应方程式为Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4,根据Ba原子守恒计算n(BaSO4)=n[Ba(OH)2]=2mol/L×0.1L=0.2mol,m(BaSO4)=nM=0.2mol×233g/mol=46.6g;
H+和OH-反应实质为H++OH-=H2O,Ba(OH)2中n(OH-)=2n[Ba(OH)2]=2×2mol/L×0.1L=0.4mol,根据H++OH-=H2O知,消耗n(H+)=n(OH-)=0.4mol,
根据H原子守恒得硫酸氢钠溶液中n(H+)=0.02mol+0.4mol=0.42mol,c(NaHSO4)=$\frac{0.42mol}{0.1L}$
=4.2mol/L,
答:生成硫酸钡的质量为46.6g,原硫酸氢钠溶液浓度为4.2mol/L.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,注意:计算前要确定哪种物质过量,以不足量者为标准进行计算,注意原子守恒的应用.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成 | 该酸雨试样中一定含有H2SO4 |
| B | 将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡 | 形成的原电池中锌作负极,银作正极 |
| C | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含有醛类化合物 |
| D | 配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe2+水解,并防止Fe2+被氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
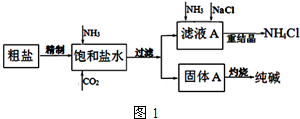 纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com