
4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 正反应是放热反应.若反应物起始的物质的量相等,下列关于该反应的示意图不正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
考点:
体积百分含量随温度、压强变化曲线.
专题:
化学平衡专题.
分析:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)正反应是放热反应,且正反应是气体体积增大的反应,升高温度,反应速率加快,到达平衡的时间缩短,化学平衡向逆反应方向移动,平衡时NO的含量降低;增大压强,反应速率加快,到达平衡的时间缩短,平衡向逆反应方向移动,平衡时NO的含量降低;催化剂能改变化学反应速率但不影响化学平衡.
解答:
解:A.正反应是放热反应,升高温度,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故A正确;
B.正反应是气体体积增大的反应,增大压强,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故B正确;
C.正反应是放热反应,升高温度,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故C错误;
D.催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡的时间,故D正确.
故选C.
点评:
本题以图象为载体考查了外界条件对化学平衡的影响,难度不大,明确催化剂能改变化学反应速率但不影响化学平衡.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:简答题
(14分)I.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为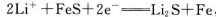 ,则该电池的总反应式为_____________________。
,则该电池的总反应式为_____________________。
Ⅱ.锂一黄铁矿高容量电池,由于其污染小、成本低、电容量大、黄铁矿储备丰富而有望取代目前市场的碱性电池。制取高纯度黄铁矿的工艺流程如下:
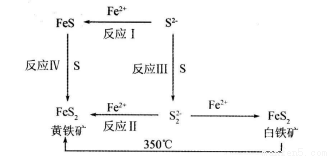
(1)已知: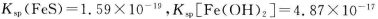 ,为得到较纯的FeS沉淀,最好在FeCl2 溶液中加入的试剂为_________(填序号)
,为得到较纯的FeS沉淀,最好在FeCl2 溶液中加入的试剂为_________(填序号)
A.(NH4)2S B.CuS C.H2S D.Na2S
(2)关于白铁矿与黄铁矿下列判断错误的是_____________(填序号)
A.属于同素异形体
B.因为晶体结构不同而导致性质有差别
C.黄铁矿比白铁矿更稳定
(3)反应Ⅲ制取 S22-时,溶液必须保持为碱性,除了S2- 与酸反应外,还有更重要的原因是(用离子方程式表示)___________________________.
(4)室温下,Li/FeS2 二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是____________________________________.
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等。请写出化学反应方程式:
第一次放电:__________________;第二次放电:__________________________。
(5)制取高纯度黄铁矿的另一种方法是:以LiCl- KC1低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解。写出阳极反应式___________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省金华十校高三下学期高考模拟(4月)理综化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且原子的最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积某气态烃只能与1体积氯气发生加成反应生成氯代烷.1mol此氯代烷可与6mol氯气发生完全的取代反应,则该烃的结构简式为( )
|
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A(g)+B(g)⇌3C(g)+4D(g)中,表示该反应速率最快的是( )
|
| A. | υA=0.5mol•L﹣1•min﹣1 | B. | υB=0.3mol•L﹣1•min﹣1 |
|
| C. | υC=0.8mol•L﹣1•min﹣1 | D. | υD=1mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)⇌CO(g)+Cl2(g);△H>0.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
|
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种新型的绿色能源,又是一种重要的化工原料.
合成氨反应的热化方程式如下:
N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ/mol
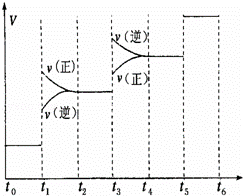
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.
图中t1时引起平衡移动的条件可能是 ,
其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0﹣t1,t1﹣t3,t3﹣t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”).
(3)温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图所示图象,写出反应的热化学方程式并回答下列问题:
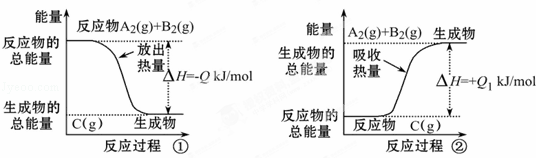
(1)反应过程①的热化学方程式为 :
(2)反应过程②的热化学方程式为:
(3)Q与Q1的关系:Q=Q1(填“<”、“>”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是()
A. 氯化钙的电子式: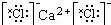
B. 168O2﹣离子的结构示意图: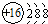
C. H2CO3的电离方程式:H2CO3⇌2H++CO32﹣
D. 葡萄糖的结构简式:C6H12O6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com