
【题目】某元素的同位素![]() ,它的氯化物XCl2 2.22g 溶于水配成溶液后,加入1molL-1的AgNO3 溶液40 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 2.22g 溶于水配成溶液后,加入1molL-1的AgNO3 溶液40 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)X元素在周期表中的位置是_____________;
(2)写出XCl2的电子式_________________;
(3)把X的单质放入水中,写出反应的化学方程式_______________________。
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、环境等社会实际密切相关。下列叙述正确的是
A.“滴水石穿、绳锯木断”不涉及化学变化
B.明矾净水的原理和“84”消毒液消毒的原理不相同
C.氟利昂作制冷剂会加剧雾霾天气的形成
D.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
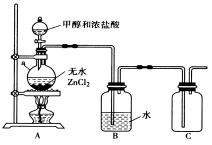
① 无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为____________________________。
② 装置B的主要作用是____________________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl= NaCl+H2O ,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为_____ _ mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
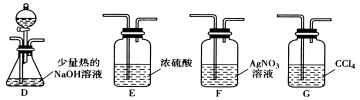
①乙组同学的实验装置中,依次连接的合理顺序为A→B→________→__ → 。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象。分液漏斗中盛放的试剂是_______和_________。
③能证明CH3Cl中含有氯元素的实验现象是_____________________________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:

①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:______________________________。
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器中,可逆反应A(s) ![]() B+C(g) △H= + QkL/mol(Q>0)达到平衡。缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大。以下分析正确的是
B+C(g) △H= + QkL/mol(Q>0)达到平衡。缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡不可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作(或实验注意事项)中,主要考虑实验安全的是( )
A. 实验剩余的药品不能放回原试剂瓶 B. 可燃性气体的验纯
C. 气体实验装置在实验前进行气密性检查 D. 滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述,错误的是
A. 第IA族元素全部是金属元素
B. 过渡元素全是金属元素
C. 第ⅦA族元素是同周期中非金属性最强的元素
D. 在元素周期表中金属与非金属的分界线附近可以寻找制造半导体的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法正确的是( )
A. 用橡皮塞把液溴密封于玻璃瓶中
B. 用磨口玻璃塞把氢氟酸密封于棕色试剂瓶中
C. 把氯气加压液化后密封于钢瓶中
D. 氯水通常保存于无色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键的断裂和新键的形成的过程。现查得:H—H、Cl—Cl和H—Cl的键能分别为436 kJ/mol、243 kJ/mol和431 kJ/mol,请用此数据估计,由Cl2、H2生成1 mol HCl时的热效应( )
A.吸热183 kJ B.放热183 kJ
C.放热91.5 kJ D.吸热91.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
主族 | ⅠA | ⅡA | Ⅲ A | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)被选作相对原子质量标准的核素是 (填核素符号)。
(2)在最高价氧化物的水化物中,酸性强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为 。
(4)从⑤到⑧的元素中, 离子半径最小(填离子符号)。
(5)元素③与⑤形成的具有强氧化性的化合物的电子式 。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com