
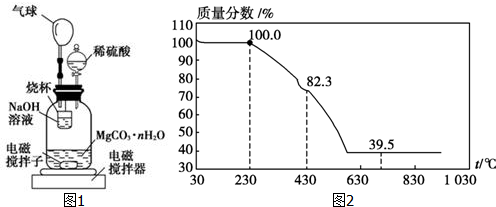
分析 (1)①控制温度在50℃需要水浴加热;
②将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,用氨水调节溶液pH到9.5,反应生成碳酸镁结晶水合物;
③步骤4检验沉淀已经洗涤干净的方法是检验洗涤液中是否含有硫酸根离子来检验是否洗净;
(2)①装置中气球可以缓冲压强并封闭装置;
②反应后期将温度升到30℃,使生成的二氧化碳全部逸出后被氢氧化钠溶液吸收;
③用已知浓度的盐酸滴定烧杯中的溶液,主要是测定溶液没有反应的氢氧化钠,所以指示剂用酚酞,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡,传导致读出的盐酸的体积偏大,据此分析;
④依据碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,结合生成二氧化碳物质的量和水的物质的量计算得到;
(3)分析图象400°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量.
解答 解:(1)①加热温度低于100°C需要水域加热控制温度,
故答案为:水浴加热;
②将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,用氨水调节溶液pH到9.5,反应生成碳酸镁结晶水合物,反应的化学方程式为Mg2++HCO3-+NH3•H2O+(n-1)H2O═MgCO3•nH2O+NH4+,
故答案为:Mg2++HCO3-+NH3•H2O+(n-1)H2O═MgCO3•nH2O+NH4+;
③步骤4检验沉淀已经洗涤干净的方法是取最后一次洗涤的滤出液,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净,
故答案为:取最后一次洗涤的滤出液,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净;
(2)①装置中气球可以缓冲压强并封闭装置,
故答案为:缓冲压强并封闭体系;
②反应后期将温度升到30℃,使生成的二氧化碳全部逸出后被氢氧化钠溶液吸收,减少测定产生的误差,
故答案为:使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收;
③用已知浓度的盐酸滴定烧杯中的溶液,主要是测定溶液没有反应的氢氧化钠,所以指示剂用酚酞,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡,传导致读出的盐酸的体积偏大,所以测出的氢氧化钠的物质的量会偏大,从而会使测CO2的量会偏小,
故答案为:酚酞;偏小;
④实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,依据元素守恒可知,碳酸镁物质的量为amol,根据化学式可知,MgCO3•nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=a:$\frac{1.000g-84ag}{18g/mol}$;得到n=$\frac{(1-84a)}{18a}$,
故答案为:$\frac{(1-84a)}{18a}$;
(3)MgCO3•nH2O n=1~5,分析图象400°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量,得到100g×$\frac{18n}{18n+84}$=100-82.3,
n=1,
故答案为:1.
点评 本题考查了物质制备实验方案的设计和分析判断,主要是图象分析的应用,装置中的反应现象和反应原理的综合应用,题目难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0℃ |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,甲醛和乙醛都是无色有刺激性气味的液体 | |
| B. | 甲醛和乙醛都易溶于水和乙醇 | |
| C. | 甲醛和乙醛都既具有氧化性,又具有还原性 | |
| D. | 等物质的量的甲醛和乙醛分别跟足量的银氨溶液反应,生成等量的银 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2FeCl2+Cl2═2FeCl3 | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | Cl2+H2O═HClO+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+,HCO3-,Cl-,Na+ | B. | Mg2+,NH4+,Cl-,NO3- | ||
| C. | Ba2+,Cu2+,OH-,Cl- | D. | Na+,SO42-,Cu2+,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com