
Ⅰ.已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去) ,请回答下列问题:
(1)请写出F的化学式 ;在②反应中,当生成2.24L的G(标准状况)时,反应中转移的电子的物质的量为 moL。
(2)若A、C、D均含有氯元素,且A中的化合价介于C与D之间,写出反应①的离子方程式: 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为 、 。(写化学式)
(4)若A与B均为 固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
Ⅱ.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应产物略去)。
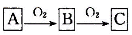
(1)若A是一种黄色非金属单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的电子式为 ,写出C和CO2反应的化学方程式,并标出单线桥 。
(3)若A是碱性气体,试写出A与氧气反应的化学方程式 。
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
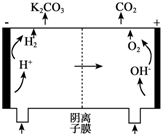 为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).
为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理来解释的是( )
A.往H2S水溶液中加碱有利于S2﹣增多
B.在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率
C.高压有利于合成NH3的反应
D.500℃左右比室温更有利于合成NH3的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
实验室欲配制6.00 mol·L-1的H2SO4溶液,现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸 ②150 mL 3.00 mol·L-1的硫酸 ③足量的18.00 mol·L-1的浓H2SO4。配制要求:①、②两种硫酸全部用完,不足部分由③补充。选用容量瓶的规格是( )
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列实验操作的描述中,正确的是 ( )
A. 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物
C. 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量
D. 利用丁达尔效应可以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列有关Na2CO3和NaHCO3性质的说法中,不正确的是
A.热稳定性:Na2CO3>NaHCO3
B.相同温度下,在水中Na2CO3的溶解度小于NaHCO3
C.106 g Na2CO3和84 g NaHCO3分别与过量盐酸反应,放出CO2的质量相等
D.Na2CO3和NaHCO3均可与澄清石灰水反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列家庭化学小实验不能达到预期目的的是
A.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用米汤检验食用加碘盐(含KIO3)中含有碘元素
D.用明矾:KAl(SO4)2·12H2O,可净化水。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com