
 .
.分析 C原子内层电子总数是最外层电子数10倍,则C为Na;已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍,说明B元素最外层电子数为6,D原子最外层电子数为3,A的次外层电子数为2;A、B、D三种元素的原子最外层电子数之和为13,则A的最外层为13-6-3=4,所以A的核外电子数为2+4=6为C元素;A和B原子最外层电子数与D和F原子最外层电子数之和相等,则F的最外层为7,F的原子序数最大,应为Cl元素;D和E是相邻两种元素,D原子最外层电子数为3,所以D为Al元素,E为Si元素;B元素最外层电子数为6,且原子序数比Na小,则为O元素,综上可知:A为C元素,B为O元素,C为Na元素,D为Al元素,E为Si元素,F为Cl元素,结合元素对应单质化合物的性质以及元素周期律解答该题.
解答 解:C原子内层电子总数是最外层电子数10倍,则C为Na;已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍,说明B元素最外层电子数为6,D原子最外层电子数为3,A的次外层电子数为2;A、B、D三种元素的原子最外层电子数之和为13,则A的最外层为13-6-3=4,所以A的核外电子数为2+4=6为C元素;A和B原子最外层电子数与D和F原子最外层电子数之和相等,则F的最外层为7,F的原子序数最大,应为Cl元素;D和E是相邻两种元素,D原子最外层电子数为3,所以D为Al元素,E为Si元素;B元素最外层电子数为6,且原子序数比Na小,则为O元素,综上可知:A为C元素,B为O元素,C为Na元素,D为Al元素,E为Si元素,F为Cl元素,
(1)E为Si元素,位于周期表第三周期、第IV族,故答案为:硅;第三周期、第IV族;
(2)AB2分子为CO2,是共价化合物,其结构式为O=C=O,B的氢化物中原子个数比1:1化合物为H2O2,电子式为 ,
,
故答案为:C=O=C; ;
;
(3)因非金属性C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则H2CO3酸性较强,故答案为:H2CO3;
(4)B为O元素,C为Na元素,D为Al元素,F为Cl,原子的电子层越多,原子半径越大;电子层相同时,核电荷数越大,原子半径越小,则原子半径最大的为Na,原子半径为Na>Al>Cl>O;一般来说离子核外电子层数越多,离子半径越大,离子核外电子数相同,原子序数越大,离子半径越小,则Al3+的半径最小;
故答案为:Na>Al>Cl>O; Al3+;
(5)由A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物为Na2CO3,继续通入二氧化碳发生CO2+CO32-+2H2O=2HCO3-,
故答案为:CO2+CO32-+2H2O=2HCO3-;
(6)M为Be元素,BeO与氢氧化钠反应生成BeO22-和H2O,其离子方程式为:BeO+2OH-=BeO22-+H2O,故答案为:BeO+2OH-=BeO22-+H2O;
(7)E和F形成的化合物X为SiCl4,SiCl4与氢气制取高纯度的单质Si的化学原理是SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl↑,故答案为:SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl↑.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,此类型题的解题规律是:先根据题干信息推断元素,再根据元素化合物知识解决有关问题,侧重于电子排布和元素周期律知识的综合应用的考查.


科目:高中化学 来源: 题型:选择题
| A. | 2K(s)+2H2O(1)═2KOH(aq)+H2(g)△H1,2Na(s)+2H2O(1)═2NaOH(aq)+H2(g)△H2,则△H1>△H2 | |
| B. | Mg(s)+2HCl(aq)═MgCl2(aq)+H2(g)△H1,Ca(s)+2HCl(aq)═CaCl2(aq)+H2(g)△H2,则△H1>△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g),H2(g)+Br2(g)═2HBr(g)△H2,则△H1>△H2 | |
| D. | 2Fe(s)+3Br2(g)═2FeBr3(s)△H1,2Fe(s)+3Cl2(g)═2FeCl3(s)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在由水电离出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、I- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32- | |
| D. | 在pH为7的溶液中:Ag+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层P轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层P轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 050 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
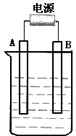 如图所示,在石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色固体物质生成,B电极有黄绿色气体生成,能使淀粉碘化钾试液变蓝.当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.回答下列问题.
如图所示,在石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色固体物质生成,B电极有黄绿色气体生成,能使淀粉碘化钾试液变蓝.当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂物质分类属于酯类 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com