
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{蒸发}{→}$无水MgCl2 | |
| D. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{盐酸}{→}$FeCl3 |
分析 A.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀;
B.S单质与氧气点燃生成的是二氧化硫;
C.氯化氢具有挥发性,蒸发氯化镁溶液得到的是氢氧化镁,不会得到氯化镁;
D.铁与水蒸气反应生成的是四氧化三铁,不会生成氧化铁.
解答 解:A.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠溶液能够与二氧化碳反应生成氢氧化铝沉淀,所以转化关系Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3一步实现,故A正确;
B.S与在氧气中燃烧生成的是SO2,不会生成SO3,所以S$→_{点燃}^{O_{2}}$SO3不能一步实现,故B错误;
C.氢氧化镁与盐酸反应生成氯化镁和水,由于HCl具有挥发性,则蒸发氯化镁溶液不会得到氯化镁固体,故C错误;
D.Fe与水蒸气在高温下反应生成四氧化三铁和氢气,不会生成氧化铁,所以Fe$→_{高温}^{H_{2}O}$Fe2O3不能一步实现,故D错误;
故选A.
点评 本题考查金属元素单质及其化合物的综合应用,题目难度中等,试题侧重于学生的分析能力的考查,注意把握物质的性质以及转化的特点、反应条件,试题培养了学生的分析能力及灵活应用能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验观察 | 离子方程式 | 解释与结论 |
| ① | 在FeCl2溶液中 滴入适量氯水 | 溶液由浅绿色 变为黄色 | 2Fe2++Cl2═2Fe3++2Cl- | Fe2+具有还原性 |
② | 在FeCl2溶液中 加入锌片 | / | Zn+Fe2+=Zn2+ +Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中 加入足量铁粉 | 溶液由黄色变成浅绿色 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 |
④ | 在FeCl3溶液中 通入H2S气体 | 溶液变为浅绿色并 有淡黄色沉淀生成 | H2S+2Fe3+=2Fe2++S↓+2H+ | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和高分子化合物PCL的合成路线如下:
和高分子化合物PCL的合成路线如下:
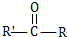 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$ (R、R′代表烃基)
(R、R′代表烃基)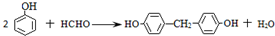 .
. .
.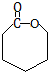 .高分子化合物PCL的结构简式是
.高分子化合物PCL的结构简式是 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:
对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol•L-1) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4;途径b:Cu$\stackrel{浓H_{2}SO_{4}}{→}$CuSO4 | |
| C. | 用金属钠可区分乙醇和乙醚 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| D. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| B. | 袋装食品常用生石灰作为食品的抗氧化剂 | |
| C. | 金属焊接时可用饱和NH4Cl溶液作除锈剂 | |
| D. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com