
【题目】已知某温度下纯水中的c(H+)=2×10-7mol/L,对此下列说法正确的是( )
A.若向水中加入少量盐酸,则水的电离度减小
B.该温度低于25℃
C.此温度下水的离子积为常温下的两倍
D.据此无法求算水中c(OH-)
【答案】A
【解析】
纯水中,H2O![]() H++OH-,c(H+)=c(OH-)=2×10-7 mol·L-1,Kw= c(H+) c(OH-)=2×10-7×2×10-7=4×10-14。
H++OH-,c(H+)=c(OH-)=2×10-7 mol·L-1,Kw= c(H+) c(OH-)=2×10-7×2×10-7=4×10-14。
A、加入盐酸,H+浓度增大,水的电离逆向移动,则水的电离度减小,A正确;
B、水的电离是吸热的,升高温度水的电离程度增大,25℃时,纯水中的c(H+)= 1×10-7mol·L-1,现纯水中c(H+)=2×10-7mol/L,水的电离被促进,说明温度升高,B错误;
C、常温下,Kw=1×10-14,该温度下,Kw= c(H+) c(OH-)=2×10-7×2×10-7=4×10-14,是常温下的4倍,C错误;
D、纯水中,H2O![]() H++OH-,c(H+)=c(OH-)=2×10-7 mol·L-1,可计算,D错误;
H++OH-,c(H+)=c(OH-)=2×10-7 mol·L-1,可计算,D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】已知:![]() 质子膜燃料电池工作原理如图。下列说法不正确的是
质子膜燃料电池工作原理如图。下列说法不正确的是![]()
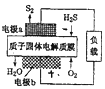
A.电池工作时,电流从电极b经过负载流向电极a
B.电极a上发生的电极反应式为![]()
C.电路中通过4mol电子时,4mol![]() 经质子膜进入正极区
经质子膜进入正极区
D.当反应生成64![]() 时,电池内部释放632kJ热量
时,电池内部释放632kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料.
![]() 已知:
已知:![]()
![]()
写出表示甲醇燃烧热的热化学方程式 ______ .
![]() 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
![]()
![]()
![]()
![]() 该反应的平衡常数表达式为 ______ .
该反应的平衡常数表达式为 ______ .
![]() 下列措施中能使平衡时
下列措施中能使平衡时![]() 减小的是
减小的是![]() 双选
双选![]() ______ .
______ .
A.加入催化剂![]() 恒容充入
恒容充入![]() ,使体系压强增大
,使体系压强增大
C.将![]() 从体系中分离
从体系中分离![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常温下用
甲醇可以氧化成甲酸,在常温下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液过程中,当混合液的
甲酸溶液过程中,当混合液的![]() 时,所消耗的
时,所消耗的![]() ______
______
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
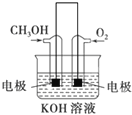
![]() 利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
![]() 合成甲醇的主要反应为:
合成甲醇的主要反应为:![]() 原料气的加工过程中常常混有一些
原料气的加工过程中常常混有一些![]() ,为了研究温度及
,为了研究温度及![]() 含量对该反应的影响,以
含量对该反应的影响,以![]() 、CO和
、CO和![]() 的混合气体为原料在一定条件下进行实验.实验数据见下表:
的混合气体为原料在一定条件下进行实验.实验数据见下表:
|
|
|
|
| ||||||||
反应温度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成![]() 的碳转化率 ______ .
的碳转化率 ______ .
结论二: ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述错误的是
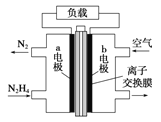
A.b极发生还原反应
B.a极的反应式为N2H4 - 4e-=N2↑+4H+
C.放电时,电流从b极经过负载流向a极
D.其中的离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
A.物质B的质量分数减小了B.平衡向逆反应方向移动了
C.平衡向正反应方向移动了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
I.若碱性锌锰干电池的总反应为:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2 ,则该电池的正极反应式为:_________________________________
II.回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
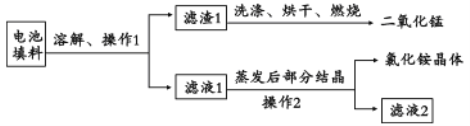
(1)① 操作中先将电池填料研碎的目的是:________________。操作l和操作2的名称都是___________,② 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)部分难溶的电解质溶度积常数(Ksp)如下表:
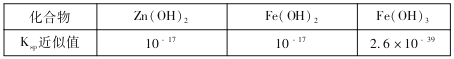
用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增小
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的105倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表述正确的是![]()
①常温时![]() 的KOH溶液与
的KOH溶液与![]() 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液![]()
②二氧化硅是酸性氧化物,但它能与某种酸反应
③![]() ,
,![]() 任何条件下都不能自发进行
任何条件下都不能自发进行
④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应:![]()
⑥![]() 的燃烧热为
的燃烧热为![]() ,则表示
,则表示![]() 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为![]() 。
。
A.①④B.①②C.④⑥D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com