
| A. | 化合反应一定是氧化还原反应 | B. | 非金属氧化物一定是酸性氧化物 | ||
| C. | 金属氧化物一定是碱性氧化物 | D. | 碱性氧化物一定是金属氧化物 |
分析 A、有的化合反应中不存在元素化合价的变化,有的存在;
B、酸性氧化物是指能和碱反应生成盐和水的氧化物;
C、碱性氧化物是指能和酸反应生成盐和水的氧化物;
D、大多数的金属氧化物属于碱性氧化物.
解答 解:A、有的化合反应中不存在元素化合价的变化,有的存在,化合反应不一定是氧化还原反应,如氧化钠和水生成氢氧化钠的反应,故A错误;
B、非金属氧化物不一定是酸性氧化物,如NO、CO等不属于酸性氧化物,故B错误;
C、金属氧化物一定是碱性氧化物,如氧化铝属于两性氧化物,故C错误;
D、大多数的金属氧化物属于碱性氧化物,碱性氧化物是指能和酸反应生成盐和水的氧化物,碱性氧化物一定是金属氧化物,故D正确.
故选D.
点评 本题涉及物质的分类、化学反应之间的关系知识,明确酸性氧化物、碱性氧化物的概念和内涵是解题的关键,难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Mn | Fe | |
| 电离能 | I1 | 717 | 759 |
| (kJ•mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致化学平衡向左移动 | |
| B. | 合成氨工业中,使用铁催化剂可加快正反应速率,提高N2、H2的转化率 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
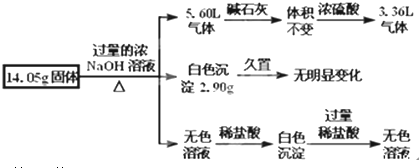
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
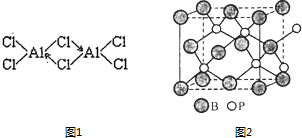 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: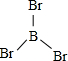 三溴化磷
三溴化磷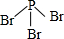
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
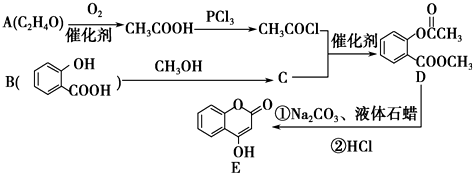
 +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O.
+H2O. 是一种重要的有机合成中间体.
是一种重要的有机合成中间体. ;②光照时,甲苯与Cl2侧链取代.
;②光照时,甲苯与Cl2侧链取代.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com