
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
分析 51.2gCu的物质的量为0.8mol,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,我们可以认为铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),据此解答.
解答 解:用终态分析法容易看出只有两种元素的价态有变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,51.2gCu的物质的量为:n(Cu)=$\frac{m}{M}$=$\frac{51.2g}{64g/mol}$=0.8mol,共失电子为0.8mol×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),故产物中NaNO2的物质的量为$\frac{1.6mol}{2}$=0.8mol,
故选D.
点评 考查氧化还原反应的有关计算,难度中等,用终态分析法判断失去的电子等于HNO3到NaNO2得到的电子是解题的关键.


科目:高中化学 来源: 题型:解答题
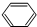 .
. +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$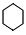
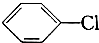 :
: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeCl3溶液时,可加入少量的稀硫酸以抑制Fe3+的水解 | |
| B. | MgCl2溶液中混有少量FeCl3杂质,可向混合溶液中加入MgO以除杂 | |
| C. | 氯化铝溶液蒸干灼烧得到的固体物质还是氯化铝 | |
| D. | 无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下22.4L HF含有的分子数约为NA | |
| B. | 常温下,1L、pH=13的氨水中OH-的数目为0.1NA | |
| C. | 1mol铁与足量硫的完全反应,失去的电子数为3NA | |
| D. | 同温、同压、同体积的氢气和臭氧具有相同的分子数和原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q中只有离子键 | |
| B. | 原子半径W>Z>Y>X | |
| C. | Y元素可形成两种含氧酸,且这两种含氧酸均为强酸 | |
| D. | 最简单氢化物的稳定性Z>Y>X,沸点Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 金属性:乙>丙>丁 | |
| B. | 原子半径大小:丁>丙>乙>己 | |
| C. | 甲、乙、丙的氧化物都含有共价键 | |
| D. | 丁和乙的原子核外电子数相差16,己和辛的原子核外电子数相差26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,氨水溶液加水稀释,$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| B. | 2SO2(g)+O2 (g)?2SO3(g)(△H<0),其它条件不变时,升高温度,v(正)增大、v(逆)减小,平衡正向移动 | |
| C. | 某容器中存在H2(g)+I2 (g)?2HI(g)反应,当减小容器体积时,气体颜色加深,各物质的百分含量不变 | |
| D. | 25℃时Mg(OH)2的Ksp小于MgF2的Ksp,则饱和Mg(OH)2与饱和MgF2相比,前者c(Mg2+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类组合 | 纯净物 | 强电解质 | 盐 | 碱性氧化物 | 分子式 |
| A | 碱石灰 | 氨水 | 纯碱 | 氧化铝 | S8 |
| B | 聚乙烯 | 碳酸钙 | 小苏打 | 氧化镁 | KCl |
| C | H2O2 | 硝酸 | 苏打 | 过氧化钠 | SiO2 |
| D | 无水硫酸铜 | 氯化银 | 碱式碳酸铜 | 氧化钠 | P4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. | 实验Ⅱ:中和热测定 | |
| C. | 实验Ⅲ:可用来制取并收集NO2 | |
| D. | 实验Ⅳ:可用于HCl气体的吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com