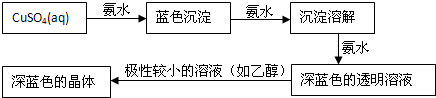
钢铁生产中的尾气易造成环境污染,清洁生产工艺可消减污染源并充分利用.已知:
①Fe
2O
3(s)+3CO(g)?Fe(s)+3CO
2(g)△H=-25kJ/mol
②3Fe
2O
3(s)+CO(g)?2Fe
3O
4(s)+CO
2(g)△H=-47kJ/mol
③Fe
3O
4(s)+CO(g)?3FeO(s)+CO
2(g)△H=+17kJ/mol
(1)试计算反应:FeO(s)+CO(g)?Fe(s)+CO
2(g)的△H=
.
(2)已知1092℃时(1)中反应的平衡常数为0.35,在1L的密闭容器中,投入7.2g FeO和0.1mol CO加热到1092℃并保持该温度,反应在t
1时达平衡.
①t
1时反应达平衡后,CO气体的体积分数为
.
②反应(1)在一定条件下达到平衡,则下列叙述表明该反应已经达到平衡状态的是
(填字母).
a.混合气体的密度不变 b.CO的浓度不再改变
c.v(CO)
正=v(CO
2)
逆 d.容器内总压强不变
(3)含铁元素的高铁酸钾(K
2FeO
4)是一种优良的水处理剂.
①K
2FeO
4溶于水是一个可逆的过程,放出一种无色无味气体.其杀菌消毒、净化吸附水中的悬浮杂质的原理可用离子方程式表示为
.
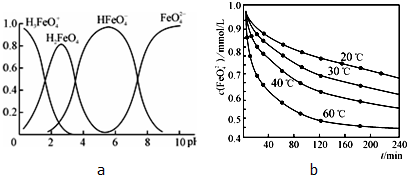
②FeO
42-在水溶液中的存在形态如图a所示,纵坐标表示分数分布.则下列说法不正确的是
(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO
4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为HFeO
4-+OH
-═FeO
42-+H
2O
③高铁酸钾还可制作充电电池,原理为:3Zn+2K
2FeO
4+8H
2O
3Zn(OH)
2+2Fe(OH)
3+4KOH
该电池充电时阳极电极反应式为
.
④将适量K
2FeO
4溶解于pH=4.74的溶液中,配制成c(FeO
42-)=1.0mmol/L的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO
42-)的变化,结果见图b.该操作的目的是
.




 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.