
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深.
回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为molL﹣1s﹣1;反应的平衡常数K1为 .
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡.
①T100℃(填“大于”或“小于”),判断理由是 .
②列式计算温度T时反应的平衡常数K2 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 . 
【答案】
(1)大于;0.001;0.36mol/L
(2)大于;正反应方向吸热,反应向吸热方向移动,故温度升高;1.28mol/L
(3)逆反应;对气体体积增大的反应,增大压强平衡向逆反应方向移动
【解析】解:(1.)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L﹣0.04mol/L=0.06mol/L,v(N2O4)= ![]() =0.001molL﹣1s﹣1;K=
=0.001molL﹣1s﹣1;K= ![]() =
= ![]() =0.36mol/L,所以答案是:大于、0.001molL﹣1s﹣1、0.36mol/L;
=0.36mol/L,所以答案是:大于、0.001molL﹣1s﹣1、0.36mol/L;
(2.)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,所以答案是:大于、正反应方向吸热,反应向吸热方向移动,故温度升高;②平衡时,c(NO2)=0.120molL﹣1+0.002molL﹣1s﹣1×10s×2=0.16molL﹣1 , c(N2O4)=0.04molL﹣1﹣0.002molL﹣1s﹣1×10s=0.020molL﹣1 , K2= ![]() =1.28mol/L,所以答案是:1.28mol/L;
=1.28mol/L,所以答案是:1.28mol/L;
(3.)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,所以答案是:逆反应、对气体体积增大的反应,增大压强平衡向逆反应方向移动.
【考点精析】认真审题,首先需要了解化学平衡常数的含义(指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态),还要掌握化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效))的相关知识才是答题的关键.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】关于海水综合利用问题,下列说法错误的是( )
A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程
B.在过程②中若要获得无水MgCl2不可直接蒸干灼烧
C.除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
D.第③④步的目的是为了浓缩富集溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(已知H2C2O4中的碳为+3价)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。试回答下列问题。
(1)该反应中氧化产物的化学式是___________;被还原的元素是___________。
(2)用双线桥标出上述反应的电子转移情况______。
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
(3)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_________mol,消耗还原剂的物质的量为___________mol。
(4)标准状况下44.8mL的ClO2气体恰好能与50mL 0.1mol·L-1的Na2SO3溶液液完全反应,生成Na2SO4,氯元素在产物中的化合价为___________;此过程说明ClO2具有____(填“氧化”或“还原”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL一定物质的量浓度的盐酸中滴加一定物质的量浓度的NaOH溶液,其pH变化如图所示,则两溶液的物质的量浓度分别是( )
A | B | C | D | |
盐酸的物质的量浓度 | 0.12 | 0.04 | 0.03 | 0.09 |
NaOH的物质的量浓度 | 0.04 | 0.12 | 0.09 | 0.03 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr====2KCl+Br2,②KClO3+6HCl(浓)====3Cl2↑+KCl+3H2O,③2KBrO3+Cl2====Br2+2KClO3,下列说法正确的是 ( )
A. 上述3个反应都是置换反应
B. 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C. 反应②中若得到6.72 L Cl2(标准状况),则电子转移个数为3.01×1023
D. ③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿氏常数,下列说法中正确的是: ( )
A.氧元素的相对原子质量为12a/b B.1mol该原子质量为bNAg
C.x g该氧原子所含电子数为8x/a D.y g 该氧原子的中子数一定为8y/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图中①、②、③、④表示不同化学元素所组成的化合物,乙图表示由四个单体构成的化合物。以下说法错误的是
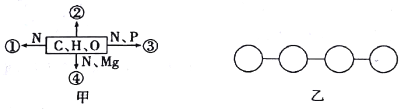
A. 若甲图中的②是良好的储能物质,则②是脂肪
B. 若甲图中④能吸收、传递和转换光能,则④可用无水乙醇提取
C. 若①是乙图中的单体,则乙表示的化合物为多(或四)肽
D. 若③是脱氧核苷酸,则由③组成的乙彻底水解后的产物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物为乙二酸。

试回答下列问题:
(1)C的结构简式是______________。
B→C的反应类型是________________,
E→F的化学方程式是___________________。
(2)E与乙二酸发生酯化反应生成环状化合物的化学方程式是__________________。
(3)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
A.①④
B.只有⑥
C.只有⑤
D.④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com