
【题目】(1)相对分子质量为70的烯烃的分子式为_____________;若该烯烃与足量的H2加成后能生
成含3个甲基的烷烃,写出该烯烃一种可能的结构简式_______________;并对其用系统命名法命名________。
(2)有机物A的结构简式为
①若A在光照条件下与氯气发生取代反应,则生成的一氯代物可能有________种结构;
②A是炔烃与氢气加成后的产物,则此炔烃可能有________种结构。
【答案】 C5H10 CH2=C(CH3)CH2CH3或(CH3)2C=CHCH3或CH2=CHCH(CH3)2 2-甲基-1-丁烯或2-甲基-2-丁烯或3-甲基-1-丁烯 7 1
【解析】(1)烯烃的通式为CnH2n,则相对分子质量为70的烯烃分子中碳原子个数是70÷14=5,分子式为C5H10;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,该烯烃可能的结构简式为CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、CH2=CHCH(CH3)2;其用系统命名法命名分别是2-甲基-1-丁烯或2-甲基-2-丁烯或3-甲基-1-丁烯。(2)①根据有机物结构简式可知分子中含有7类氢原子,因此生成的一氯代物可能有7种结构;②烷烃分子中相邻碳原子上各去掉2个氢原子即可形成碳碳三键,因此如果A是炔烃与氢气加成后的产物,则此炔烃可能有1种结构:CH≡CCH(CH3)CH(CH3)C(CH3)3。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】物质结构决定物质性质,回答下列涉及物质结构和性质的问题。
(1)笫二周期中,元素的第一电离能处于B与N之间的元素有______ 种。
(2)某元素位于第四周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为___________。
(3)AlC13是有机合成和石油化工的催化剂,已知AlCl3可以通过配位键形成具有桥式结构的双聚分子Al2Cl6,Al2Cl6分子的结构式为_________。
(4)KCN可被H2O2氧化为KOCN。KOCN可作为制药材料,其晶体类型是________,碳原子采取sp杂化,1mol该物质中含有的π键数目为______;H2O2常温下是液体,沸点较高(150℃),其主要原因是____________。
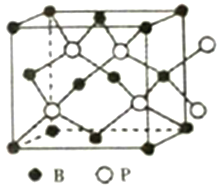
(5)氮化硼(BN)和磷化硼(BP)都是受到高度关注的耐磨涂料,它们结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是________。
(6)磷化硼晶体的晶胞结构如图所示,在BP晶胞中B原子的堆积方式为______,若图中立方体的边长为a pm,则磷化硼中硼原子和磷原子之间的最近距离为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关SiO2或硅酸盐的说法正确的是
A. 水泥、石英玻璃、陶瓷均是硅酸盐产品
B. 硅太阳能电池板所用的是高纯度SiO2
C. 钢化玻璃与普通玻璃成分相同
D. SiO2既能与HF酸反应又能与NaOH反应,故SiO2为两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种血小板聚集抑制剂,该药物以2-氯苯甲醛为原料的合成路线如下:

请根据以上信息,结合自己的掌握知识和具有的经验回答下列问题:
(1)分子C中除氯原子外的官能团名称为_________。
(2)X的结构简式为____________。
(3)D→E的反应类型是__________反应。
(4)分子C在一定条件下生成一种含有3个六元环的产物的化学方程式_________________
(5)同时满足下列两个条件的B的同分异构体共有____种(不包括B)
①与B含有相同的官能团 ②苯环上的取代基不超过2个。
(6)已知: ![]() 则由乙醇、甲醇为有机原料制备化合物
则由乙醇、甲醇为有机原料制备化合物![]() ,构成需要经历的反应类型有_______ (填写编号)。
,构成需要经历的反应类型有_______ (填写编号)。
①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物![]() 的最后一步反应________________
的最后一步反应________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g/cm3),所得溶液的密度为ρg/cm3,质量分数为ω,物质的量浓度为cmol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度:c=1 mol/L
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:ω=36.5c/1 000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石[主要成分是Cu2(OH)2CO3]炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石(主要成分是MgCl2)中炼镁。下列分析不正确的是
A. ①用于(Ⅰ) B. ②用于(Ⅱ) C. ③用于(Ⅲ) D. ④用于(Ⅳ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
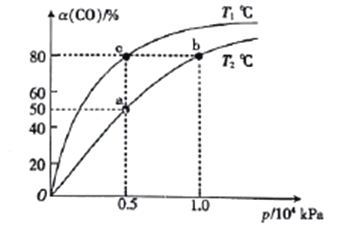
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com