
| A、分子数相同 | B、质量相同 |
| C、原子数相同 | D、密度相同 |
| V |
| Vm |
| V |
| Vm |
| M |
| Vm |
| V |
| Vm |
| V |
| Vm |
| M |
| Vm |


科目:高中化学 来源: 题型:
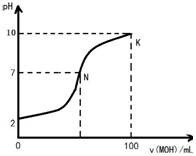 常温下,向100mL 0.01mol?L-1盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )
常温下,向100mL 0.01mol?L-1盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )| A、MOH是弱碱 | ||
| B、N点c(Cl-)=c(M+) | ||
C、随着MOH溶液的滴加,比值
| ||
| D、K点对应的溶液c(MOH)+c(OH-)-c(H+)=0.001mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、CS2、HI都是直线形的分子 |
| B、BF3键角为120°,SnBr2键角大于120° |
| C、COCl2、BF3、SO3都是平面三角形的分子 |
| D、PCl3、NH3、PCl5都是三角锥形的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.714g/mL |
| B、0.714g/L |
| C、0.179g/L |
| D、0.275g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol CuSO4?5H2O的质量为250g/mol |
| B、CuSO4?5H2O的摩尔质量为250g |
| C、CuSO4?5H2O的摩尔质量为250g/mol |
| D、配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4?5H2O 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:
某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com