
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
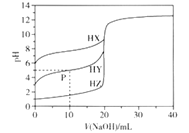
A. 电离常数Ka(HX)的数量级为10-12
B. HX的电离程度大于X-的水解程度
C. pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
【答案】D
【解析】A.根据图像,0.100 mol/LHX溶液的pH=6,则Ka(HX)=![]() =
=![]() = 10-11,故A错误;B. X-的水解平衡常数Kh=
= 10-11,故A错误;B. X-的水解平衡常数Kh=![]() =
=![]() =10-3>Ka(HX),HX的电离程度小于X-的水解程度,故B错误;C.根据电荷守恒,pH=7时,三种溶液中都存在c(X-) = c1(Na+),c(Y-)= c2(Na+),c(Z-)== c3(Na+),而三种酸的强弱不同,则pH=7时,消耗的氢氧化钠的体积不同,即c1(Na+)≠ c2(Na+)≠ c3(Na+),故C错误;D. P点对应的溶液中存在等浓度的HY和NaY,溶液显酸性,说明以HY的电离为主,则c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-),故D正确;故选D。
=10-3>Ka(HX),HX的电离程度小于X-的水解程度,故B错误;C.根据电荷守恒,pH=7时,三种溶液中都存在c(X-) = c1(Na+),c(Y-)= c2(Na+),c(Z-)== c3(Na+),而三种酸的强弱不同,则pH=7时,消耗的氢氧化钠的体积不同,即c1(Na+)≠ c2(Na+)≠ c3(Na+),故C错误;D. P点对应的溶液中存在等浓度的HY和NaY,溶液显酸性,说明以HY的电离为主,则c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-),故D正确;故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】普罗帕酮是广谱高效抗心律失常的药物,它由有机物X经多步反应合成的过程如下:

下列说法正确的是( )
A. 普罗帕酮的分子式为C19H24NO3
B. X,Y的核磁共振氢谱图中都有4组特征峰
C. 含少量X与Y的普罗帕酮可用烧碱溶液进行提纯
D. 一定条件下,X、Y和普罗帕酮都能发生加成、取代、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
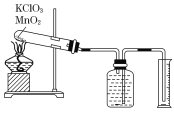
实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置,检查装置的气密性。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL.
⑤准确称量试管和残留物的质量为15.55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________________________________________。
(2)试管中发生的化学反应方程式为:_______________________________________。
(3)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是___________(请填写步骤代码)。
进行③的实验操作时,若仰视读数,则读取氧气的体积________(填“偏大”、“偏小”或“无影响”)。
(4)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。回答下列问题:
(1)已知:①1g H2 完全燃烧生成H2O(g)放出121kJ 的热量;
②N2(g) +O2(g)==2NO(g) △H =+180.5kJ·mol-1
③4NH3(g) +5O2(g)==4NO(g) +6H2O(g) △H =-906.2kJ·mol-1
工业合成氨的热化学方程式是_________________________________________。
(2)应用化石燃料(特别是煤)制备的原料气H2 中含有杂质碳( 主要成分为CO2)、杂质硫主要成分为H2S)。工业上采用湿法脱硫的方法回收硫,方法是先用纯碱溶液吸收H2S,使之转化为NaHS,然后用偏钒酸钠(NaVO3)溶液氧化硫元素,使之转化为硫单质,并生成焦钒酸钠( Na2V4O9),混法脱硫中发生的氧化还原反应的化学方程式是_________________________,反应中转移2×103mol电子时,理论上回收硫_______kg。
(3)工业上利用NH3为原料合成尿素,其原理是2 NH3(g) +CO2(g)![]() CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
合成尿素的反应为_____________(填“放热反应”或“吸热反应”)。
②合成尿素的原料气中NH3和CO2的物质的量之比称为氨碳比,可用[n(NH3)]/[n(CO2)]表示。在一定温度和压强下,图甲中曲线________(填“I”或“II”)表示的是氨碳比与CO2的转化率(a)的关系,判断理由是_______________________________;当[n(NH3)]/[n(CO2)]=4时,NH3的转化率为_______________。

(4)利用特殊的材料,通过电化学法也可以合成氨,如图乙所示原理可利用N2、H2、CO、水蒸气合成氨。阳极反应式是_______________,离子交换膜中通过的离子是_____(填化学符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,表中所列字母分别代表一种元素.

试回答下列问题:
(1)以上元素中,属于d区元素的是________(填元素符号),h在周期表的位置是_________。
(2)由e、f以原子个数1∶1形成的晶体中,化学键类型为______________。
(3)元素k的基态原子电子排布式为__________;画出c的核外电子排布图:_____________。
(4)元素c的电负性______元素g的电负性(填“>”、“=”、“<”),元素b、c、e的第一电离能由大到小的顺序是___________________(用元素符号表示)。
(5)工业上冶炼g元素的单质的化学方程式_______________________________,f、 h两种元素最高价氧化物对应的水化物反应的化学方程式是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com