
【题目】下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.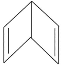
(1)这两种结构的化学性质区别表现在:Ⅰ不能____(填字母,下同),而Ⅱ能____。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)已知Ⅰ结构下,该物质能在一定条件下与液溴反应,其反应方程式为________________。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的四氯代物有______种。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿的空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
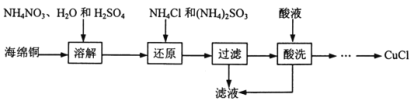
(1)基态铜原子核外电子排布式为:________。
(2)为了提高溶解速率,可以适当加热到60~70℃,还可以采用的措施为________。
(3)溶解步骤的温度控制在60~70℃,温度不宜过高的原因是________。该步骤中Cu 与NH4NO3反应的离子方程式为 (N元素被还原到最低价)_________________。
(4)还原步骤发生反应的离子方程式为______________________。
(5)滤液的主要成分为__________(写化学式)。
(6)酸洗时,可选用稀硫酸或稀盐酸,但不能用浓盐酸的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤
B.食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验
C.火柴头中的氯元素检验的实验中,将火柴头![]() 未燃烧
未燃烧![]() 浸于水中,片刻后取少量溶液,加
浸于水中,片刻后取少量溶液,加![]() 溶液、稀硝酸,若出现白色沉淀,证明有氯元素
溶液、稀硝酸,若出现白色沉淀,证明有氯元素
D.毒物误入口内,可将![]() 稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院
稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,先后顺序正确的是
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.酸碱中和滴定时,锥形瓶先用标准液洗涤后,再注入待测液
C.在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
D.为检验酸性溶液中的![]() 和
和![]() ,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是
A.实验时手指不小心沾上苯酚,立即用浓NaOH溶液清洗
B.用润湿的红色石蕊试纸置于试管口,试纸变蓝,证明有氨气产生
C.将氯化铝溶液加热蒸发,最后可得到氯化铝晶体
D.酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液
查看答案和解析>>
科目:高中化学 来源: 题型:
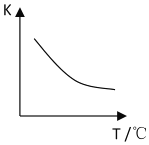
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象______.
(2)写出A中反应的化学方程式______
(3)继续向A试管中加入![]() ,发现铜片溶解,反应的离子方程式为:______.
,发现铜片溶解,反应的离子方程式为:______.
(4)若仍不补充浓硫酸,只要求使铜片溶解,也可以加入![]() 填写两种属于不同类别物质的化学式
填写两种属于不同类别物质的化学式![]() ______、______.
______、______.
(5)![]() 试管口的棉花应沾有的试剂是______.
试管口的棉花应沾有的试剂是______.
小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体![]() 小组成员采用加热法测定该晶体里结晶水x的值.
小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量______次;
②下面是其中一次实验的数据:
坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
|
|
|
根据上表数据计算判断x的实测值比理论值![]() ______
______![]() 填“偏大”、“偏小”
填“偏大”、“偏小”![]() ,这次实验中产生误差的原因可能是______
,这次实验中产生误差的原因可能是______![]() 填序号
填序号![]()

A.硫酸铜晶体中含有不挥发的杂质![]() 实验前晶体表面有湿存水
实验前晶体表面有湿存水
C.加热时有晶体飞溅出去![]() 加热失水后露置在空气中冷却.
加热失水后露置在空气中冷却.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com