
【题目】室温下,向10mL pH=11的NH3·H2O溶液中加入下列物质,对所得溶液的分析正确的是( )
加入的物质 | 对所得溶液的分析 | |
A. | 90mL H2O | 由水电离出的c(H+)=10-10mol·L-1 |
B. | 0.1mol NH4Cl固体 | c(H+)比原NH3·H2O溶液中的大 |
C. | 10mL pH=13的NaOH溶液 | NH3·H2O的电离程度不变 |
D. | 10mL pH=3的盐酸 | 溶液呈中性 |
A.AB.BC.CD.D
【答案】B
【解析】
A、向10mL pH=11的NH3·H2O溶液中加入90mL H2O,由于氨水的电离,c(OH-)>10-4 mol·L-1,由水电离出的c(H+)>10-10mol·L-1,选项A错误;
B、向10mL pH=11的NH3·H2O溶液中加入0.1mol NH4Cl固体,c(NH4+)增大,电离平衡NH3·H2O![]() NH4++ OH-逆向移动,c(OH-)减小,c(H+)增大,比原NH3·H2O溶液中的大,选项B正确;
NH4++ OH-逆向移动,c(OH-)减小,c(H+)增大,比原NH3·H2O溶液中的大,选项B正确;
C、向10mL pH=11的NH3·H2O溶液中加入10mL pH=13的NaOH溶液,c(OH-)增大,抑制NH3·H2O电离,NH3·H2O的电离程度减小,选项C错误;
D、向10mL pH=11的NH3·H2O溶液中加入10mL pH=3的盐酸,NH3·H2O过量,反应后溶液呈碱性,选项D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别是
组别 | c(HCl)/molL-1 | 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
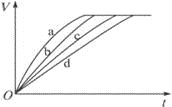
A.4-3-2-1
B.1-2-3-4
C.3-4-2-1
D.1-2-4-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是___,E2D2的电子式为___。
(2)AFD的结构式为___,BD2的电子式为___。
(3)EDA的电子式为___,AF的电子式为___。
(4)B元素形成的化合物种类繁多的原因可能是(填序号)___。
①碳原子之间成键方式多样化,碳碳之间可以单键、双键或者叁键
②同分异构现象的普遍存在
③碳碳之间可以通过共价键彼此结合成链状或者环状
(5)元素D、E、F形成的简单离子的半径由大到小为__(用离子符号表示)。
(6)用电子式表示E与F形成化合物的过程___。
(7)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成镇痛药哌替啶M。

已知:ⅰ.R—NH2+![]()
![]() RNHCH2CH2OH
RNHCH2CH2OH
ⅱ.![]()
(1)A→B的化学方程式是__。
(2)B→C的反应类型是__。
(3)D的核磁共振氢谱只有一个吸收峰,其结构简式是__。
(4)D→E的化学方程式是__。
(5)G中含有两个六元环,其结构简式是__。
(6)I和H反应生成镇痛药哌替啶M的化学方程式是__。
(7)写出同时符合下列条件的C的同分异构体的结构简式__(写出一种即可)。
①分子中有苯环且是苯的邻位二取代物;
②核磁共振氢谱表明分子中有6种氢原子;红外光谱显示存在碳氮双键(C=N)。
(8)以C为原料可以合成重要的医药中间体对氨基苯乙酸,合成路线如下:
![]()
①写出Y的结构简式__。
②合成路线中反应条件Fe/HCl的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
A.2mol SO2(g)和1mol O2(g)所具有的总能量小于2mol SO3(g)所具有的能量
B.将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小
D.将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2molSO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物之间的转化关系如图.
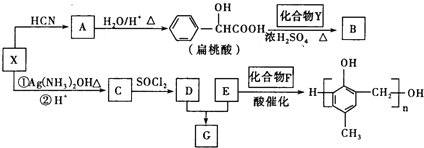
已知以下信息:
①RCHO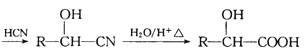
②RCOOH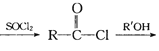 RCOOR’(R、R’代表烃基)
RCOOR’(R、R’代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y
④化合物F的核磁共振氢谱图中只有一个吸收峰
回答下列问题:
(1)X的含氧官能团的名称是___,X与HCN反应生成A的反应类型是__。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是__。
(3)G在NaOH溶液中发生水解反应的化学方程式是__。
(4)![]() 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有__种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式__。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有__种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
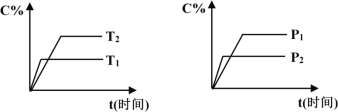
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com