
【题目】A、B、D、E、F为短周期元素,非金属元素 A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的 2 倍。 B在 D中充分燃烧能生成其最高价化合物 BD2。E+与D2-具有相同的电子数。 A 在 F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是____________,写出单质 F和NaOH的离子方程式____________。
(2)B、D、E 组成的一种盐中, E的质量分数为43%,其俗名为________ ,其水溶液与等物质的量的 F单质反应的化学方程式为___________________;
(3)由这些元素组成的物质,其组成和结构信息如下表:

a的化学式为_______;b与水反应的化学方程式为_______;
【答案】第一周期IA主族 Cl2 + 2OH-=Cl— + ClO— + H2O 纯碱 Na2CO3+ Cl2 +H2O= NaHCO3 +NaCl+ HClO NaH 2Na2O2 +2H2O=4NaOH+O2↑
【解析】
非金属元素A最外层电子数与其周期数相同,A为H元素;A 在 F中燃烧,产物溶于水得到一种强酸,F是Cl元素;D形成D2-,说明D最外层有6个电子,E+与D2-具有相同的电子数,E是Na元素、D是O元素;B在 D中充分燃烧能生成其最高价化合物 BD2,B为+4价,B的最外层电子数是其所在周期数的 2 倍,则B是C元素。据此解答。
(1)A是H元素,在周期表中的位置是第一周期IA主族,单质 F是氯气,氯气和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式是Cl2 + 2OH-=Cl- + ClO- + H2O;
(2)C、O、Na 组成的一种盐中, Na的质量分数为43%,该盐是Na2CO3,其俗名为纯碱,氯气和水反应生成盐酸和次氯酸,酸性HCl>H2CO3>HClO>HCO3-,根据强酸制弱酸,碳酸钠与等物质的量的氯气反应生成碳酸氢钠、氯化钠、次氯酸,反应方程式是Na2CO3+ Cl2 +H2O= NaHCO3 +NaCl+ HClO;
(3)金属元素与非金元素易形成离子化合物,含有H的二元离子化合物是NaH;b是含有非极性共价键的二元离子化合物,原子个数比是1:1,b是Na2O2,Na2O2与水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2 +2H2O=4NaOH+O2↑。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入铝粉能放出氢气的溶液:Na+、Mg2+、Cl-、NO3-;
B.由水电离出的c(OH-)=1.0×10-12mol·L-1的溶液:Fe2+、NH4+、ClO-、SO42-
C.![]() =1.0×10-12的溶液:K+、SO32-、S2-、Cl-
=1.0×10-12的溶液:K+、SO32-、S2-、Cl-
D.c(NH4+)=c(Cl-)的NH4Cl-NH3·H2O混合液:Al3+、Fe3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.S(g)+O2(g)=SO2(g) △H1, S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2。
B.由C(石墨)=C(金刚石) ΔH=+119kJ·mol-1可知,金刚石比石墨稳定。
C.在稀溶液中:H+(aq)+OH-(aq) ===H2O(l);ΔH=-57.3kJ·mol-1,若将含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量等于57.3kJ。
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) ===2H2O(l);ΔH=-571.6kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐: 0.7molKCl、0.2molKClO和X。则X是
A. 0.1molKClO4 B. 0.1molKClO3
C. 0.2molKClO2 D. 0.1molKClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
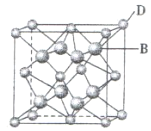
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)C原子基态时的电子排布式为_______________,元素A、B、C、F的原子半径由大到小的顺序_________。
(2)A2F的分子空间构型为_______________,FO3分子中F原子的杂化方式______________。
(3)从图中可以看出,D 与B形成的离子化合物的化学式为__________(用元素符号表示),该离子晶体的密度为ag·cm-3,则晶胞的体积是_________(写出表达式即可,不用化简)。
(4)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则E的晶体中E原子的配位数为________。
(5)氮化硼(BN)是一种重要的功能陶瓷材料,其晶胞结构如图所示。请回答下列问题:
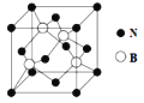
B和N相比,电负性较大的是_________,氮化硼的晶体类型______,氮化硼的晶胞中有几个氮原子_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )
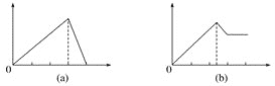
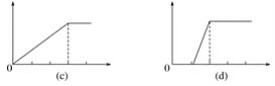
A.①-(d)B.②-(b)C.③-(c)D.④-(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为____;
(2)B元素的负一价离子的电子层结构与氩相同,C元素的正一价离子的电子层结构与氙相同,B、C形成的化合物的化学式为____;其晶体内每个B离子周围有____个C离子与之紧相邻。
(3)D元素的正三价离子的3d亚层为半充满,其基态原子的电子排布式为_____,已知:D(CO)5中D元素为0价,在一定条件下,发生分解反应D(CO)5=D(s)+5CO,反应过程中,形成的化学键是____。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。其单质在一定条件下能与氧气反应,试写出该反应方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com