
【题目】下列实验方案不合理的是 ( )
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸等杂质
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.制备FeC13溶液时,先将固体溶于较浓盐酸,再加水稀释
D.用干燥的pH试纸测量某酸溶液的pH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CH﹣CH3)的结构或性质正确的是( )
A.不能使酸性高锰酸钾溶液褪色
B.不能在空气中燃烧
C.能使溴水褪色
D.与HCl在一定条件下能加成只得到一种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知B为黑色粉末,用D,E,G做焰色反应实验,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图1所示. 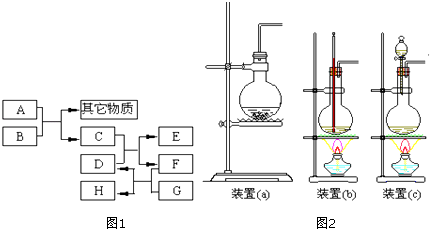
(1)请根据以上关系进行判断,指出下列物质的化学式:
A , C , D , G .
(2)写出下列反应的化学方程式:C+D:;A+B: .
在A和B的反应中,A显示出来的性质是(填写序号,多选倒扣).
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性
当A和B进行反应时,应选择图2所示装置中的较为合适.
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2某些性质的装置图。若观察到装置④中有淡黄色沉淀生成,⑤中的溴水褪色(已知因含有Br2而溴水呈红棕色),请回答: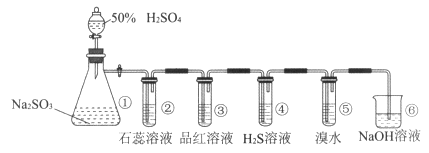
(1)①中发生反应的离子方程式是。
(2)②中的实验现象是。
(3)③的实验现象是 , 证明SO2有性。
(4)④中SO2做剂。
(5)⑤中反应生成两种强酸,该反应的离子方程式是 , 当1 molSO2参与反应时,转移电子的物质的量是。
(6)⑥的作用是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.碳酸钙和盐酸反应:CO32﹣+2H+═CO2↑+H2O
B.过量的氯化铁和锌反应,锌溶解:2Fe3++Zn═2Fe2++Zn2+
C.醋酸和苯酚钠溶液的反应: ![]() O﹣+CH3COOH→
O﹣+CH3COOH→ ![]() OH↓+CH3COO﹣
OH↓+CH3COO﹣
D.碳酸氢钠溶液与氯化铝溶液反应:Al3++3HCO3﹣═Al(HCO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 , 充分反应,测得最后溶液的pH>7.
(1)此时溶液的溶质如果是单一成分,可能是;如果是多种成分,可能是 .
(2)在上述所得溶液中,逐滴缓慢滴加2molL﹣1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式 .
②B点时,反应所得溶液中溶质的物质的量浓度是(溶液体积的变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机中生成NO的反应为:N2(g)+O2(g)2NO(g),t℃时,K=0.09.在t℃下甲、乙、丙三个恒容密闭容器中,投入N2(g)和 O2(g)模拟反应,起始浓度如表所示.下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(N2)/molL﹣1 | 0.46 | 0.46 | 0.92 |
c(O2)/molL﹣1 | 0.46 | 0.23 | 0.92 |
A.起始时,反应速率:丙>甲>乙
B.平衡时,c(NO):甲=丙>乙
C.平衡时,N2的转化率:甲>乙
D.平衡时,甲中c(N2)=0.4 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施中,不能提高化学反应速率的是
A. Zn与稀硫酸的反应中,用Zn片代替Zn粉
B. KC103的分解反应中,适当提高反应温度
C. H202的分解反应中,添加适量MnO2
D. 合成氨的反应中,增大体系的总压力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( ) 
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10﹣5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X﹣)>c(Y﹣)>c(OH﹣)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)═ ![]() +c(Z﹣)+c(OH﹣)
+c(Z﹣)+c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com