
【题目】无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
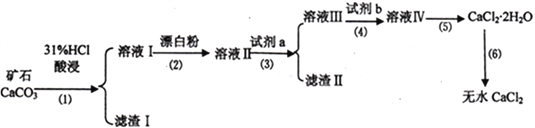
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。
【答案】 把矿石磨成粉 ④ 2Fe2++2H++ClO-= 2Fe3++Cl-+ H2O 冷却结晶、过滤 7.8>pH≥5.3 2.0×10-12 2.0×10-11 0.9250(或92.50%)
【解析】工业碳酸钙矿石(含有少量SiO2、Fe2O3、Al2O3、FeCO3等杂质),由图矿石酸溶之后滤渣I为二氧硅,滤液I中含Fe2+、Fe3+、Al3+,加漂白粉将Fe2+氧化成Fe3+,用试剂调节pH,将铝和铁除去。(1)为了提高步骤(1)的反应速率,可以采取的措施是把矿石磨成粉等方法,(2)只能加盐酸,加其它酸会引入杂质离子。故选④;(3)步骤(2)的离子方程式 2Fe2++2H++ClO-= 2Fe3++Cl-+ H2O;(4)步骤(5)用到的操作方法有蒸发浓缩、冷却结晶、过滤;(5)加入试剂a的目的是调节溶液的pH,确保铝以氢氧化铝的形式存在,调节pH的范围为7.8>pH≥5.3;(6)Fe(OH)3开始沉淀时,Ksp[Fe(OH)3]=8.0×10-38=c3(OH-)c(Fe3+),c(Fe3+)=0.01 mol·L-1时,c3(OH-)=8.0×10-38/0.01 ,得要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为c(OH-)= 2.0×10-12mol·L-1;Fe3+沉淀完全时,浓度小10-5mol·L-1,Ksp[Fe(OH)3]=8.0×10-38=c3(OH-)c(Fe3+),c(Fe3+)=10-5mol·L-1时,c3(OH-)=8.0×10-38/10-5 ,Fe3+沉淀完全时,溶液中c(OH-)最小为 2.0×10-11mol·L-1;(7)样品中n(Cl-)=0.05000mol·L-1×0.02500L×10=0.0125mol,根据n(AgCl)=2n(CaCl2),则n(CaCl2)=0.006250mol,所以m(CaCl2)=0.06250mol×111g·mol-1=0.69375g,则有:0.69375g/0.7500g ×100%=92.5%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,①②③④分别是几种常见漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品均已略去,铁架台、铁夹也已略去)。请根据实际使用操作时上述漏斗的使用范围和它们的形状,指出A、B、C、D分别与①②③④中哪一种最为匹配:A与_____________,B与______________,C与_______________,D与_______________。
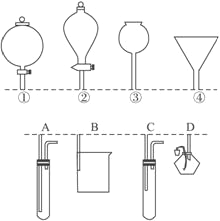
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将 20.0 g 质量分数为 14.0%的 KNO3溶液与 30.0 g 质量分数为 24.0%的 KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数_________。
(2)混合后溶液的物质的量浓度_______。
(3)在1000g水中需溶解______molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
(4)标况下44.8LHCl溶于水配成500mL溶液。计算:
①HCl的物质的量____________________;
②所得溶液中溶质的物质的量浓度____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)燃料电池的工作原理如右图,有关叙述正确的是

A. 该装置能实现化学能100%转化为电能
B. 电子移动方向为:a极→b极→质子交换膜→a极
C. a电极的电极反应式为:CH3OCH3+3H2O=2CO2+12e-+12H+
D. 当b电极消耗22.4LO2时,质子交換膜有4moIH+通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A.16O2与18O2互为同分异构体
B.16O和18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅酸钠以下说法不正确的是( )
A. 硅酸钠与盐酸反应的离子方程式:SiO32—+2H+=H2SiO3↓
B. 硅酸钠溶液俗称“泡花碱”,其溶液显碱性,滴加酚酞显红色
C. Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
D. 水玻璃久置在空气中变质,因为与空气中的CO2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。

(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com